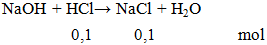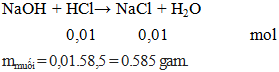NaOH + HCl → NaCl + H2O

Phản ứng NaOH + HCl → NaCl + H2O cung cấp thông tin chi tiết về công thức và điều kiện phản ứng Bài viết này sẽ giúp bạn hiểu rõ hiện tượng và phương trình rút gọn của phản ứng này Bên cạnh đó, còn có bài tập vận dụng liên quan giúp bạn nắm vững kiến thức
1. Phương trình phản ứng NaOH + HCl → NaCl + H2O:
NaOH + HCl → NaCl + H2O
2. Điều kiện phản ứng xảy ra NaOH + HCl → NaCl + H2O:
Phản ứng xảy ra ngay điều kiện thường.3. Hiện tượng phản ứng giữa NaOH + HCl → NaCl + H2O:
– Nhỏ từ từ HCl vào dung dịch có chứa NaOH màu tím của một mẩu quỳ.4. Phương trình rút gọn của NaOH + HCl → NaCl + H2O:
– Ban đầu, mẩu quỳ tím có màu xanh, sau khi tiếp tục thêm từ từ HCl, mẩu quỳ mất màu, trong khi dư lượng HCl làm cho mẩu quỳ chuyển sang màu đỏ.5. Bài tập vận dụng liên quan:
Cách cân bằng phương trình NaOH + HCl → NaCl + H2O:Để cân bằng phương trình NaOH + HCl → NaCl + H2O, chúng ta cần đảm bảo số nguyên tử và tổng điện tích trên cả hai bên của phương trình là bằng nhau.
Phương trình ban đầu: NaOH + HCl → NaCl + H2O
Bước 1: Cân bằng số nguyên tử của các nguyên tố không thuộc về oxi (trừ oxi và hiđrô). NaOH + HCl → NaCl + H2O
Bước 2: Cân đối số nguyên tử oxi. 2NaOH + HCl → NaCl + H2O
Bước 3: Cân đối số nguyên tử hiđrô. Trên bên trái, có 2 nguyên tử hiđrô từ 2NaOH, trong khi trên bên phải chỉ có 2 nguyên tử hiđrô từ H2O. Ta thấy rằng số nguyên tử hiđrô đã cân đối, không cần điều chỉnh thêm.
Vậy, phương trình cân đối là: 2NaOH + HCl → NaCl + H2O
Để cân bằng phương trình hóa học NaOH + HCl → NaCl + H2O một cách chính xác nhất, hãy làm theo những bước sau:
Bước 1: Xác định số nguyên tử của các nguyên tố trong phương trình. Trong phương trình này, có 1 nguyên tử natri (Na), 1 nguyên tử oxi (O), 1 nguyên tử hidro (H) và 1 nguyên tử clo (Cl).
Bước 2: Cân bằng các nguyên tố khác oxi và hidro. Trong phương trình này, chỉ có natri (Na) và clo (Cl) không cân bằng. Để cân bằng chúng, ta sẽ thay đổi hệ số trước các chất trong phương trình.
NaOH + HCl → NaCl + H2O
2NaOH + 2HCl → 2NaCl + H2O
Bước 4: Kiểm tra lại phương trình đã cân bằng xem số nguyên tử của mỗi nguyên tố trên cả hai bên có bằng nhau không.
Sau khi thực hiện các bước trên, phương trình đã được cân bằng.
2NaOH + 2HCl → 2NaCl + 2H2O
Cách giải phương trình NaOH + HCl → NaCl + H2O:
Phương trình hoá học chưa cân bằng là NaOH + HCl → NaCl + H2O.
NaOH + HCl → NaCl + H2O
Bước 2: Cân bằng số nguyên tử của các nguyên tố, trừ hiđrô và oxi. Trong phản ứng này, ta có một nguyên tử natri (Na), một nguyên tử hiđrô (H), một nguyên tử clo (Cl) và một nguyên tử oxi (O).
NaOH + HCl → NaCl + H2O 1 1 1 1
Bước 3: Cân bằng số nguyên tử hydrogen (H) và oxi (O) bằng cách thêm các hệ số phù hợp vào các phân tử nước (H2O).
NaOH + HCl → NaCl + H2O 1 1 1 2
Vậy phương trình đã được cân bằng và có dạng:
NaOH + HCl → NaCl + 2H2O
Ví dụ 1:
Cho 0,1 mol NaOH phản ứng vừa đủ với 100ml HCl aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 1.
Hướng dẫn giải
a = 0,1 : 0,1 = 1M.
Đáp án D.
Ví dụ 2:
Phản ứng nào sau đây là phản ứng trung hòa?
A. 2NaOH + CO2 → Na2CO3 + H2O
B. NaOH + SO2 → NaHSO3
C. NaOH + HCl → NaCl + H2O
D. 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2 ↓
Hướng dẫn giải
Phản ứng trung hòa là phản ứng NaOH + HCl → NaCl + H2O
Đáp án C.
Ví dụ 3:
100ml dung dịch HCl 0,1M phản ứng hoàn toàn với dung dịch NaOH. Ta thu được dung dịch X. Giá trị khối lượng muối tan trong dung dịch X là:
A. 0,745g.
Hướng dẫn giải
Đáp án C.
PHƯƠNG PHÁP GIẢI
A. Bài toán CO2, SO2 dẫn vào dung dịch NaOH, KOH
– Khi cho CO2 (hoặc SO2) tác dụng với dung dịch NaOH đều xảy ra 3 khả năng tạo muối:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt T = nNaOH/nCO2
– Nếu T = 2 : chỉ tạo muối Na2CO3
– Nếu T = 1 : chỉ tạo muối NaHCO3
– Nếu 1 < T < 2 : tạo cả muối NaHCO3 và Na2CO3
Có những bài toán không thể tính T. Trong trường hợp đó, ta phải sử dụng các dữ kiện phụ để xác định khả năng tạo muối.
Một ví dụ là hấp thụ CO2 vào sodium hydroxide dư (hoặc potassium hydroxide dư) chỉ tạo ra muối trung hòa sodium carbonate (hoặc potassium carbonate).
Khối lượng muối Na2CO3 tạo thành sau quá trình hấp thụ CO2 tăng.
m bình tăng = m dd tăng = m chất hấp thụ ( CO2 + H2O có thể có )
– Trong trường hợp không có các dữ kiện trên thì chia trường hợp để giải.
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
T= nCO2/nCa(OH)2
– Nếu T = 1 : chỉ tạo muối CaCO3
– Nếu T = 2 : chỉ tạo muối Ca(HCO3)2
– Nếu 1 < T < 2: tạo cả muối CaCO3 và Ca(HCO3)2
Khi không thể tính được T trong các bài toán, chúng ta sẽ sử dụng dữ kiện phụ để tìm ra khả năng tạo ra muối.
– Khi hấp thụ CO2 vào nước vôi dư, chỉ có thể tạo ra muối CaCO3.
- Khi hấp thụ CO2 vào nước vôi, ta thấy có sự hình thành kết tủa. Sau đó, thêm NaOH dư vào, ta lại thấy có sự hình thành kết tủa khác nữa, từ đó suy ra cả CaCO3 và Ca(HCO3)2 đã được tạo thành.
- Khi hấp thụ CO2 vào nước vôi, ta thấy có sự hình thành kết tủa. Sau đó, lọc bỏ kết tủa và đun nóng lại nước lọc, ta lại thấy sự hình thành kết tủa khác nữa, từ đó suy ra cả CaCO3 và Ca(HCO3)2 đã được tạo thành.
– Sự tăng giảm khối lượng dung dịch : Khi cho sàn phẩm cháy vào bình Ca(OH)2 hay Ba(OH)2
m bình tăng = m hấp thụ
m dd tăng = m hấp thụ – m kết tủa
m dd giảm = m kết tủa – m hấp thụ
- Nếu thiếu các dữ kiện trên, chúng ta phải xem xét các trường hợp để giải quyết.
C. Để làm tốt loại bài tập này, chúng ta cần hiểu tỉ lệ mol và cách đặt số mol phù hợp. Một số bài cần sử dụng phương trình ion rút gọn khi gặp các bài tập liên quan đến CO2 + hh (NaOH và Ca(OH)2).
CO2 + 2OH– → CO32- + H2O (1)
CO2 + OH– → HCO3– (2)
T = nOH-/nCO2
– Nếu T = 2 : chỉ tạo muối CO32-
– Nếu T = 1 : chỉ tạo muối HCO3–
– Nếu 1 < T < 2 : tạo cả muối HCO3– và CO32-
Dạng 1: một mol CO2 phản ứng với dung dịch kiềm có b mol (NaOH, Ca(OH)2, hoặc Ba(OH)2). Yêu cầu: Tính khối lượng kết tủa CaCO3 hoặc BaCO3 được tạo ra. Cách làm rất đơn giản:
– Nếu thấy a < b thì => ĐS: = a mol .
– Nếu thấy a > b thì => ĐS: = 2b – a
2. Khối lượng của từng muối thu được ( muối HCO3– và muối CO32- )
Cách làm rất đơn giản:
Trước tiên: lấy = T , Nếu thấy giá trị 1 < T < 2
Thì sẽ có 2 muối sinh ra ( đó là HCO3– và CO32-
Dạng 2: Cho V (lit) CO2 (đktc) phản ứng với dung dịch kiềm b mol (NaOH, Ca(OH)2 hoặc Ba(OH)2) để tạo thành x mol kết tủa (↓). Yêu cầu: Tính thể tích khí CO2. Thường có 2 ĐS.
Dạng 3: a mol CO2 + Ca(OH)2 hay Ba(OH)2 → b mol kết tủa. Tính Ca(OH)2
II. BÀI TẬP MẪU
Giải: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05 M sẽ tạo ra một lượng kết tủa X và dung dịch Y. Chúng ta cần biết độ tăng hoặc giảm khối lượng của dung dịch Y so với dung dịch cơ ban Ca(OH)2 ban đầu.
CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 0,1 0,1
2CO2 + CaCO3 + H2O → Ca(HCO3)2
0,16 – 0,1 → 0,06
=> n↓= 0,04 mol
n↓= 0,04 mol => m ↓ = 4g < 0,16 . 44 = 7,04g
=> mdd tăng = 7,04 – 4 = 3,04g
Câu 2. Khi thổi V lít khí CO2 (đktc) vào 100ml dung dịch Ca(OH)2 1M, thu được khối lượng kết tủa là 6g. Sau đó, lọc kết tủa và đun nóng dung dịch ta nhận thấy vẫn còn có kết tủa. Hãy tìm giá trị của V?
Lời giải
Dd sau phản ứng ↓ => có Ca(HCO3)2 taọ thành
→
BTNT Ca 0,1 = 0,06 + nCa(HCO3)2 => nCa(HCO3)2 = 0,04 mol
nCO2= nCaCO3 + 2. nCa(HCO3)2 = 0,14 mol
VCO2 = 3,136 l
CO2 + 2OH– → CO32- + H2O
0,105 0,21 → 0,105
CO2 + CO32- + H2O → 2HCO3–
0,045 →0,045 → 0,09
nCO32- = 0,06mol
Ca2+ + CO32- → CaCO3
0,06 0,06 0,06
=> m↓ = 6g
Dd => m crắn = 0,09 . 84 = 7,56g
Câu 4. Sục 4,48 lít khí CO2 (đktc) vào 500ml dd NaOH 0,1 M và Ba(OH)2 0,2M tính m kết tủa thu được?
Lời giải
nCO2 = 0,2 mol. nOH- = 0,25 mol, nBa2+ = 0,1 mol
CO2 + 2OH– → CO32- + H2O
0,1250,25 → 0,125
CO2 + CO32- + H2O → 2HCO3–
0,075 →0,075 → 1,5
nCO32- = 0,05mol
Ba2+ + CO32- → BaCO3
0,05 0,05
=> m↓ = 0,05 . 197 = 9,85g
Câu 5. Cho hh khí A gồm CO2 và SO2 có dA/ H2 = 27. Đưa a mol hh khí A qua bình chứa 1 lít dung dịch NaOH có nồng độ 1,5aM. Sau phản ứng và cô cạn cẩn thận, thu được dung dịch sau đó có khối lượng m (g) muối khan. Tìm giá trị của m dựa trên giá trị của a?
Gọi CT chung của 2 oxit MO2 → MMO2 = 54 => M = 22(g)
PP nối tiếp
MO2 + 2NaOH→ Na2MO3 + H2O
0,75a 1,5a → 0,75a
MO2 + Na2CO3 + H2O → 2NaHCO3
0,25a → 0,25a
Sau phản ứng
=> m = 0,5a . (46 + 22 + 48) + 0,5a . (24+22+48) = 105a
III. BÀI TẬP ÁP DỤNG
Bài 1. Dung dịch X chứa NaOH 0,2M và Ca(OH)2 0,1M. Sục 7,84 lít khí CO2 (đktc) vào 1 lít dung dịch X thì khối lượng kết tủa thu được là
A. 15 gam.
B. 5 gam.
C. 10 gam.
D. 20 gam.
Bài 2. Cho một thể tích V lít (đktc) khí CO2 tác dụng với 200 ml dung dịch Ca(OH)2 1M, kết quả thu được 10 gam kết tủa. Hãy tính thể tích V của khí CO2.
A. 2,24 lít.
B. 6,72 lít.
Câu 3. Trong 100ml dung dịch chứa NaOH 0,02M và Ba(OH)2 0,02M và hấp thụ hoàn toàn 56ml khí CO2. Khối lượng kết tủa được thu được là:
A. 0,0432 gam
B. 0,4925 gam
C. 0,2145 gam
D. 0,394 gam
Bài 4: Đẩy V lít khí CO2 (ở điều kiện tiêu chuẩn) qua 500 ml dung dịch Ca(OH)2 có nồng độ M, sau phản ứng thu được 3 gam kết tủa và dung dịch A. Đun nóng dung dịch A sẽ thu được thêm 2 gam kết tủa. Giá trị của V và x là
A. 1,568 lít và 0,1 M B. 22,4 lít và 0,05 M
C. Với V là lít khí SO2 có trong đktc và 700 ml dung dịch Ca(OH)2 0,1 M, sau khi phản ứng xảy ra, thu được 5 gam kết tủa. Tìm giá trị của V là:
A. 2,24 lít hay 1,12 lít
B. 1,68 lít hay 2,016 lít
C. 2,016 lít hay 1,12 lít
D. 3,36 lít
Bài 6. Đốt 8,96 lít H2S (đktc) sau đó hòa tan khí sản phẩm vào dung dịch NaOH có nồng độ 25% (mật độ = 1,28 g/ml), thu được 46,88 gam muối. Thể tích dung dịch NaOH là: A. 100 ml. B. 80ml.
Bài 7. Đốt cháy hoàn toàn 8,8 gam FeS và 12 gam FeS2 sẽ thu được một lượng khí. Lấy khí này sục vào V ml dung dịch NaOH có nồng độ 25% (d=1,28 g/ml) sẽ tạo thành một lượng muối trung hòa. Tìm giá trị tối thiểu của V.
A. 1,080 gam
B. 2,005 gam
C. 1,6275 gam
D. 1,085 gam
Bài 9. Đốt cháy m gam FeS trong khí O2 dư, ta thu được khí X. Khí X được hoàn toàn hấp thụ vào 200 ml dung dịch gồm NaOH 0,1 M và Ba(OH)2 0,1 M. Sau phản ứng, ta thu được dung dịch Y và có 4,34 gam kết tủa. Khi cho dung dịch NaOH vào dung dịch X, ta tiếp tục thấy có kết tủa. Giá trị của m là:
A. 2,53 gam
B. 3,52 gam
C. 3,25 gam
D. 1,76 gam
Bài 10: Cho 500 ml dung dịch NaOH 0,16M phản ứng với 1,568 lít khí CO2 (đktc). Sau phản ứng, thu được dung dịch A. Tiếp theo, rót 250 ml dung dịch B gồm BaCl2 0,16M và Ba(OH)2 xM vào dung dịch A, kết quả là có 3,94 gam kết tủa và dung dịch C. Tính nồng độ xM của Ba(OH)2.
Câu 11. Khi nung nóng m gam MgCO3 cho đến khi khối lượng không đổi, ta thu được V lít khí CO2 (ở điều kiện tiêu chuẩn). Hấp thụ hoàn toàn V lít CO2 vào dung dịch Ca(OH)2 0,1 M có thể thu được 2,5 gam kết tủa và dung dịch X. Khi thêm dung dịch NaOH dư vào X, thu được a gam kết tủa. Giá trị của V và a là:
A. 1,232 lít và 1,5 gam
B. 1,008 lít và 1,8 gam
C. 1,12 lít và 1,2 gam
D. 1,24 lít và 1,35 gam
Bài 12. Cho m gam FeCO3 tác dụng với dung dịch HNO3 đặc nóng (dư) thu được hỗn hợp khí X. Khi hút hoàn toàn X vào dung dịch Ca(OH)2 0,05 M dư, ta thấy có V lít dung dịch Ca(OH)2 phản ứng và thu được 2 gam kết tủa. Giá trị m và V là:
A. 3,2 gam và 0,5 lít
B. 2,32 gam và 0,6 lít
C. 2,22 gam và 0,5 lít D. 2,23 gam và 0,3 lít
ĐÁP ÁN
| 1 | B | 4 | A | 7 | B | 10 | A |
| 2 | D | 5 | C | 8 | D | 11 | A |
| 3 | B | 6 | B | 9 | B | 12 | B |