NaHCO3 + HCl → NaCl + CO2 + H2O

NaHCO3 + HCl → NaCl + CO2 + H2O là một bài viết hữu ích giúp người đọc tiết kiệm thời gian và công sức trong quá trình làm việc Bài viết này cung cấp các thông tin về phương trình phản ứng, điều kiện, hiện tượng và phương trình rút gọn của quá trình này Bên cạnh đó, còn cung cấp các bài tập vận dụng liên quan để người đọc thực hành
1. Phương trình phản ứng NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình phản ứng được viết như sau:NaHCO3 + HCl → NaCl + CO2 + H2O
Trong phản ứng này, khi sodium bicarbonate (NaHCO3) phản ứng với hydrochloric acid (HCl), sẽ tạo thành sodium chloride (NaCl), carbon dioxide (CO2), và water (H2O). Đây là một loại phản ứng trao đổi kết hợp.
2. Điều kiện phản ứng xảy ra NaHCO3 + HCl → NaCl + CO2 + H2O:
Phản ứng trên đây là một phản ứng trao đổi, trong đó natri hidrocarbonat (NaHCO3) phản ứng với axit clohidric (HCl) tạo ra muối natri clorua (NaCl), khí cacbonic (CO2), và nước (H2O).Công thức hoá học chi tiết của phản ứng là: 2 NaHCO3 + 2 HCl → 2 NaCl + CO2 + 2 H2O
Để xảy ra phản ứng, cần phải tiếp xúc NaHCO3 với HCl. Nhiệt độ cũng có thể ảnh hưởng đến tốc độ phản ứng, nhưng phản ứng này có thể xảy ra ở nhiệt độ phòng.
Lưu ý rằng phản ứng trên là phản ứng hoá học và chỉ áp dụng trong điều kiện phòng hoặc trong một môi trường thích hợp để tiến hành thí nghiệm. Thực hiện phản ứng hoá học đòi hỏi sự chú ý và kiến thức về an toàn. Do đó, nếu bạn không có kinh nghiệm thí nghiệm hoặc không đủ hiểu biết, hãy tham khảo ý kiến và sự hướng dẫn của một chuyên gia hoặc giáo viên.
3. Hiện tượng phản ứng giữa NaHCO3 + HCl → NaCl + CO2 + H2O:
Phản ứng giữa natri hidrocacbonat (NaHCO3) và axit clohidric (HCl) là một phản ứng trao đổi ion. Phản ứng có thể được biểu diễn như sau:NaHCO3 + HCl → NaCl + CO2 + H2O
Trong phản ứng này, NaHCO3 phản ứng với HCl để tạo thành NaCl, CO2 và H2O.
Đây là một phản ứng axit-baz trong đó HCl là một axit mạnh và NaHCO3 là một baz yếu. Khi phản ứng diễn ra, HCl sẽ tạo thành ion Cl- và H+, trong khi NaHCO3 sẽ tạo thành ion Na+ và các ion bicarbonate (HCO3-). Các ion này sau đó sẽ tương tác với nhau và tạo ra muối NaCl, khí CO2 và nước.
Muối NaCl là một muối có thể hòa tan trong nước và tồn tại dưới dạng các ion Na+ và Cl-. Trong quá trình này, khí CO2 sẽ được giải phóng và tồn tại dưới dạng các phân tử CO2 khí. Nước được tạo thành từ phản ứng này là nước thông thường (H2O).
Tóm lại, phản ứng giữa NaHCO3 và HCl tạo ra muối NaCl, khí CO2 và nước.
4. Phương trình rút gọn của NaHCO3 + HCl → NaCl + CO2 + H2O:
Phản ứng NaHCO3 + HCl → NaCl + CO2 + H2O có thể được viết tắt thành:NaHCO3 + HCl → NaCl + CO2 + H2O
5. Bài tập vận dụng liên quan:
Mở rộng kiến thức về NaHCO3 (natri bicacbonat)Tính chất
– NaHCO3 là chất rắn, màu trắng, dễ tan trong nước.
– NaHCO3 dễ bị nhiệt phân hủy tạo thành Na2CO3 và khí CO2:
– NaHCO3 có tính lưỡng tính (vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazơ)
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Ứng dụng
NaHCO3 được dùng trong công nghiệp dược phẩm (chế tạo thuốc đau dạ dày …) và công nghiệp thực phẩm (làm bột nở …).
Kiến thức về axit clohidric HCl
Tính chất vật lí
– Hiđro clorua tan vào nước tạo thành dung dịch axit clohiđric.
– Axit clohiđric là chất lỏng, không màu, mùi xốc.
– Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
của dung dịch HCl đặc rất mạnh, có khả năng ăn mòn các kim loại và gây tổn thương cho da và môi trường. Bên cạnh đó, HCl cũng là chất tạo axit quan trọng trong quá trình tráng bạc và sản xuất hợp chất hữu cơ.
Axit clohiđric là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
– Làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại.
Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
– Tác dụng với oxit bazơ và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl →to”>to→→ CuCl2 + H2O
Fe2O3 + 6HCl →to”>to→→ 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
– Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Dung dịch axit HCl đặc không chỉ có tính axit đặc trưng mà còn có tính khử khi tác dụng với các chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3...
. Quá trình sản xuất
a) Trong phòng thí nghiệm
– Để điều chế hiđro clorua, chúng ta sẽ cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat), sau đó hấp thụ chất này vào nước để thu được axit clohiđric.
– Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc →t0≥400o”>t0≥400o−−−→→ Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc →t0≤250o”>t0≤250o−−−→→ NaHSO4 + HCl ↑
b) Trong công nghiệp
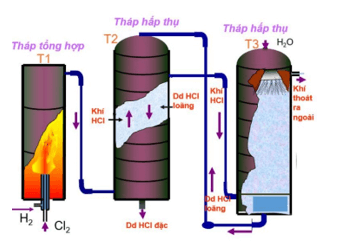
– Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
H2 + Cl2 →t0″>t0→→ 2HCl
– Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
Cách cân bằng phương trình NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình ion thu gọn của phản ứng NaHCO3 tác dụng với HCl
Bước 1: Viết phương trình phân tử:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Bước 2: Chuyển các chất dễ tan và có tính dẫn điện mạnh thành ion; Đối với chất kết tủa, chất khí và chất dẫn điện yếu, chúng ta giữ nguyên dưới dạng phân tử và có thể biểu diễn bằng phương trình ion hoàn chỉnh:
Na+ + HCO3– + H+ + Cl– → Na+ + Cl– + CO2↑ + H2O
Bước 3: Lược bỏ đi các ion giống nhau ở 2 vế ta được phương trình ion rút gọn:
HCO3– + H+ → CO2↑ + H2O
Để cân bằng phương trình hóa học, ta cần điều chỉnh số lượng các chất tham gia và sản phẩm sao cho tỉ lệ số mol của các nguyên tử trong phương trình trở nên như nhau. Sau đây là các bước để cân bằng phương trình hóa học chuẩn nhất NaHCO3 + HCl → NaCl + CO2 + H2O:
Bước 1: Xác định số lượng nguyên tử của từng nguyên tố trong phương trình. Trong trường hợp này:
Bên trái: Na = 1, H = 1, C = 1, O = 3
Bên phải: Na = 1, Cl = 1, C = 1, O = 3, H = 2
Bước 2: Tiến hành cân bằng số lượng nguyên tử của các nguyên tố chưa cân bằng. Trong trường hợp này, chỉ có Cl chưa cân bằng.
Bước 3: Cân bằng số lượng Cl trên cả hai bên bằng cách thêm các hệ số phù hợp vào các chất phản ứng và sản phẩm. Cần thêm hệ số 2 trước HCl để cân bằng số lượng Cl. Phương trình sẽ trở thành:
NaHCO3 + 2HCl → NaCl + CO2 + H2O
Bước 4: Kiểm tra lại số lượng nguyên tử của mỗi nguyên tố và chắc chắn rằng phương trình đã được cân bằng.
Trái vế trái: Na = 1, H = 2, C = 1, O = 3
Trái vế phải: Na = 1, Cl = 2, C = 1, O = 3, H = 2
Bước 5: Xác minh lại tỷ lệ phần trăm nhỏ nhất. Trong trường hợp này, không có tỷ lệ nhỏ hơn 1 nên phương trình đã được cân bằng hoàn toàn.
Phương trình hóa học cân bằng chuẩn nhất là: NaHCO3 + 2HCl → NaCl + CO2 + H2O.
Cách giải phương trình NaHCO3 + HCl → NaCl + CO2 + H2O:
Phương trình hóa học bạn đưa ra là một phản ứng trao đổi, trong đó sodium bicarbonate (NaHCO3) và hydrochloric acid (HCl) tác dụng với nhau để tạo ra sodium chloride (NaCl), carbon dioxide (CO2), và water (H2O). Đây là phản ứng trung hòa axit.
Cách giải phương trình này là sử dụng quy tắc cân bằng phương trình hóa học. Đầu tiên, chúng ta cần cân bằng số nguyên tử cho mỗi nguyên tố trên cả hai phía của phản ứng.
Phía trái của phản ứng: NaHCO3 + HCl
Phía phải của phản ứng: NaCl + CO2 + H2O
Bây giờ, chúng ta sẽ bắt đầu cân bằng phương trình bằng cách thay đổi các hệ số phía trước các tạp chất cho đến khi số lượng nguyên tử của mỗi nguyên tố được cân bằng.
NaHCO3 + HCl → NaCl + CO2 + H2O
Để cân bằng số nguyên tử của natri (Na), chúng ta cần đặt hệ số 2 phía phải của NaCl.
NaHCO3 + HCl → 2NaCl + CO2 + H2O
Tiếp theo, chúng ta điều chỉnh số lượng nguyên tử của cacbon (C) và hydro (H). Chúng ta phải đặt hệ số 2 ở phía trái của HCl và 1 ở phía phải của CO2.
NaHCO3 + 2HCl → 2NaCl + CO2 + H2O
Cuối cùng, chúng ta cần điều chỉnh số lượng nguyên tử oxi (O). Để thực hiện điều này, ta sẽ đặt hệ số 2 phía bên phải của phương trình cho H2O và 2 phía bên phải của phương trình cho NaHCO3.
2NaHCO3 + 2HCl → 2NaCl + CO2 + 2H2O
Vậy, phương trình đã được cân bằng và có dạng:
2NaHCO3 + 2HCl → 2NaCl + CO2 + 2H2O
Câu 1: Rót từ từ 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau khi phản ứng ta thu được số mol CO2 là:
A. 0,020
B. 0,030
C. 0,015
D. 0,010
Đáp án D
Câu 2: Cho từ dung dịch chứa a mol axit clohidric vào dung dịch X chứa b mol muối natri cacbonat đồng thời khuấy đều, thu được V lít khí (đktc) và dung dịch Y. Khi cho dư nước vôi vào dung dịch Y thấy xuất hiện kết tủa. Biểu thức liên hệ giữa V với a và b là?
A. V = 22,4(a – b) B. V = 11,2(a – b)
C. V = 11,2(a + b) D. V = 22,4( a + b)
Đáp án A
Câu 3: Cho một hỗn hợp gồm kim loại kiềm Na và K. Đun hỗn hợp này trong nước sẽ tạo ra dung dịch A và 0,672 lít khí H2 ở điều kiện tiêu chuẩn. Tính thể tích dung dịch HCl 0,1M cần dùng để trung hòa một phần ba của dung dịch A.
A. 100 ml. B. 200 ml. C. 300 ml. D. 600 ml.
Đáp án A
Câu 4: Muối được dùng để chế thuốc chữa đau dạ dày do thừa axit trong dạ dày là
A. Na2CO3. B. NaHCO3. C. NH4HCO3. D. NaF.
Đáp án B
Muối NaHCO3 có khả năng trung hòa axit trong dạ dày
NaHCO3 + HCl → NaCl + H2O + CO2↑”>↑↑