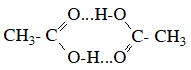
HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O

HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O là phản ứng hóa học quan trọng, có thể giúp tiết kiệm thời gian và công sức Bài viết này cung cấp phương trình, điều kiện, hiện tượng và phương trình rút gọn của phản ứng Đồng thời, cũng cung cấp bài tập vận dụng liên quan Hãy tham khảo ngay!
1. Phương trình phản ứng HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O:
2Cu(OH)2 + HCOOH → CO2 + Cu2O ↓ + 3H2O
2. Điều kiện phản ứng xảy ra HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O:
Điều kiện phản ứng: Nhiệt độ.3. Hiện tượng phản ứng giữa HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O:
Dung dịch đã tạo thành kết tủa Cu(OH)2 sau khi thêm axit fomic và đun nóng nhẹ có màu đỏ gạch, tạo ra chất Cu2O.4. Phương trình rút gọn của HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O:
Phản ứng hóa học giữa axit formic (HCOOH) và hydroxit đồng (II) (Cu(OH)2) được rút gọn thành phương trình sau: Cu(OH)2 + HCOOH -> Cu2O + CO2 + H2O.2HCOOH + Cu(OH)2 → Cu2O + 2CO2 + 3H2O
5. Bài tập vận dụng liên quan:
Cách cân bằng phương trình HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O:Để cân bằng phương trình hóa chất HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O, chúng ta thực hiện các bước sau đây:
Bước 1: Xác định số lượng nguyên tử các nguyên tố trong mỗi chất trước và sau phản ứng.
HCOOH: 1 nguyên tử cacbon, 2 nguyên tử oxi, 2 nguyên tử hydro
Cu(OH)2: 1 nguyên tử đồng, 2 nguyên tử oxi, 2 nguyên tử hydro
Cu2O: 2 nguyên tử đồng, 1 nguyên tử oxi
CO2: 1 nguyên tử cacbon, 2 nguyên tử oxi
H2O: 2 nguyên tử hydro, 1 nguyên tử oxi
Bước 2: Sắp xếp và điều chỉnh các hệ số tương ứng để làm cân bằng phản ứng.
HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O
Bằng cách xem xét số lượng nguyên tử các nguyên tố trong mỗi phần tử, ta có thể thấy rằng:
Phần tử O: 2O (trong HCOOH) + 2O (trong Cu(OH)2) = 3O (trong Cu2O) + 2O (trong CO2) + 1O (trong H2O)
Để cân bằng số nguyên tử O, cần thêm hệ số 3 trước Cu2O và hệ số 2 trước CO2:
HCOOH + Cu(OH)2 → 3Cu2O + 2CO2 + H2O
Tiếp theo, ta xem xét số nguyên tử H:
Phần tử H: 2H (trong HCOOH) + 2H (trong Cu(OH)2) = 4H (trong H2O)
Vì vậy, ta cần thêm hệ số 4 trước H2O:
HCOOH + Cu(OH)2 → 3Cu2O + 2CO2 + 4H2O
Cuối cùng, ta xem xét số nguyên tử Cu:
Phần tử Cu: 1Cu (trong Cu(OH)2) = 3Cu (trong Cu2O)
Vậy ta cần thêm hệ số 3 trước Cu(OH)2:
HCOOH + 3Cu(OH)2 → 3Cu2O + 2CO2 + 4H2O
Bây giờ phương trình đã được cân bằng.
Để cân bằng phương trình hóa học HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O một cách chuẩn nhất, bạn có thể thực hiện các bước sau:
Bước 1: Xác định số lượng nguyên tử của các nguyên tố trong phương trình.
H: 2 nguyên tử (ở cả hai bên)
C: 1 nguyên tử (ở cả hai bên)
O: 4 nguyên tử (2 nguyên tử từ HCOOH và 2 nguyên tử từ Cu(OH)2)
Bước 2: Cân bằng các nguyên tố không liên quan trước.
Trong trường hợp này, chỉ cần cân bằng nguyên tố C. Nhận thấy cả hai phía của phương trình đều có một nguyên tử C, do đó nguyên tố C đã được cân bằng.
Bước 3: Đồng đẳng nguyên tố O bằng cách thêm các hệ số ngoại số vào các chất có chứa nguyên tử O.
Bên trái: Có 2 nguyên tử O trong HCOOH và 2 nguyên tử O trong Cu(OH)2, tổng cộng là 4 nguyên tử O. Bên phải: Có 2 nguyên tử O trong CO2 và 1 nguyên tử O trong H2O, tổng cộng là 3 nguyên tử O.
Để cân bằng số nguyên tử O, ta cần thêm hệ số ngoại số 2 trước CO2:
HCOOH + Cu(OH)2 → Cu2O + 2CO2 + H2O
Bước 4: Để cân bằng số nguyên tử H, chúng ta thêm các hệ số ngoại số vào các chất có chứa nguyên tử H.
Ở phía trái: Có 2 nguyên tử H từ HCOOH và 2 nguyên tử H từ Cu(OH)2, tổng cộng là 4 nguyên tử H. Ở phía phải: Có 2 nguyên tử H từ H2O.
Để cân bằng số nguyên tử H, ta cần thêm hệ số ngoại số 4 trước H2O:
HCOOH + Cu(OH)2 → Cu2O + 2CO2 + 4H2O
C, 4 nguyên tử H, 2 nguyên tử O, 1 nguyên tử Cu.
Phương trình oxi-hoá khử HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O có thể được giải như sau:
Bước 1: Xác định các nguyên tử và cân bằng phần tử oxi-hoá Trong HCOOH, ta có:
Nguyên tử carbon (C): 1
Nguyên tử oxi (O): 2
Nguyên tử hydro (H): 2
Trong Cu(OH)2, ta có:
Nguyên tử đồng (Cu): 1
Nguyên tử oxi (O): 2
Nguyên tử hydro (H): 2
Bước 2: Tiến hành cân bằng số nguyên tử hydro bằng cách thêm hệ số trước các phân tử hoặc ion chứa hydro.
Phương trình ban đầu: HCOOH + Cu(OH)2 → Cu2O + CO2 + H2O
Nhận thấy số nguyên tử hydro chưa cân bằng, do đó ta cần điều chỉnh bằng cách thêm hệ số trước phân tử nước (H2O).
Phương trình sau khi cân bằng số nguyên tử hydro: HCOOH + Cu(OH)2 → Cu2O + CO2 + 2H2O
Bước 3: Cân bằng số nguyên tử oxi bằng cách thêm hệ số phía trước các phân tử hoặc ion chứa oxi. Phương trình hiện tại: HCOOH + Cu(OH)2 → Cu2O + CO2 + 2H2O
Ta nhận thấy rằng hiện tại tỷ lệ số nguyên tử oxi không cân đối. Để đạt được sự cân đối này, chúng ta cần điều chỉnh hệ số trước phân tử CO2.
Phương trình sau khi cân bằng số nguyên tử oxi là: HCOOH + Cu(OH)2 → Cu2O + 2CO2 + 2H2O.
Bước 4: Hãy kiểm tra lại số nguyên tử carbon. Trong phương trình đã cân bằng, mỗi bên có 1 nguyên tử carbon.
Phương trình cuối cùng sau khi cân bằng là: HCOOH + Cu(OH)2 → Cu2O + 2CO2 + 2H2O
Ví dụ 1: Có 3 lọ mất nhãn chứa các dung dịch sau: HCOOH, CH3COOH, C2H5OH. Dùng hóa chất nào để phân biệt các dung dịch trên?
A. dd AgNO3/NH3 B. NaOH
C. Na D. Cu(OH)2/OH–
Đáp án D
Hướng dẫn giải:
HCOOH: xuất hiện kết tủa đỏ gạch (Cu2O)
CH3COOH: Cu(OH)2 bị hòa tan thành dung dịch màu xanh
C2H5OH: không có hiện tượng
Ví dụ 2: Trong 5 bình không có nhãn chứa các dung dịch: dung dịch axit formic, dung dịch axit axetic, rượu etylic, glycerol và CH3CHO. Sử dụng chất hóa học nào để phân biệt được tất cả các dung dịch trên?
A. AgNO3/NH3, quỳ tím
B. Cu(OH)2, Na2CO3
C. nước brom, quỳ tím
D. AgNO3/NH3, Cu(OH)2
Đáp án D
Hướng dẫn giải:
Khi thêm Cu(OH)2 vào, chỉ có ống nghiệm chứa ancol etylic, glixerol và CH3COOH sẽ có một kết tủa màu xanh nhạt.
- Nhóm 1: Quan sát thấy Cu(OH)2 tan chảy và sau phản ứng, dung dịch có màu xanh là HCOOH, trong khi ống nghiệm kia không có hiện tượng gì, tức là CH3CHO.
- Nhóm 2: Khi thêm Cu(OH)2, quan sát thấy dung dịch sau phản ứng tạo phức màu xanh là chứa glycerol, dung dịch sau phản ứng có màu xanh nhạt là CH3COOH, còn ống nghiệm lại không có hiện tượng gì, tức là ancol etylic.
Bản chất của các chất tham gia phản ứng
Bản chất của HCOOH (Axit fomic)
- Trong phản ứng trên, HCOOH được coi là chất khử.
- Do HCOOH chứa nhóm chức của andehit -CHO, nên khi hỗn hợp HCOOH và Cu(OH)2 được đun nóng, sẽ tạo thành kết tủa màu đỏ gạch là Cu2O.
Bản chất của Cu(OH)2 (Đồng hidroxit)
– Trong phản ứng trên Cu(OH)2 là chất oxi hoá.
– Cu(OH)2 có đầy đủ tính chất của một hidroxit không tan tác dụng được với nhóm chức andehit -CHO.
Kiến thức về axit cacboxylic
Tính chất vật lý
– Ở ĐK thường các axit cacboxylic đều là những chất lỏng hoặc rắn.
– Nhiệt độ sôi tăng theo chiều tăng M và cao hơn các ancol có cùng M do các phân tử axit cacboxylic có liên kết hiđro bền hơn liên kết hidro giữa các phân tử ancol.
a.Tính axit
– Trong dung dịch, axit cacboxylic phân li thuận nghịch: CH3COOH ⇔ H+ + CH3COO–
Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ
– Tác dụng với bazơ, oxit bazơ tạo thành muối và nước:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
– Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
– Tác dụng với kim loại trước hiđro: 2CH3COOH + Zn → (CH3COO)2Zn + H2
b. Phản ứng thế nhóm –OH:
Phản ứng giữa axit và ancol được gọi là phản ứng este hóa.
RCOOH + R’OH ⇔ RCOOR’ + H2O
Phản ứng thuận nghịch, xúc tác H2SO4 đặc.
Điều chế
a.Phương pháp lên men giấm:
C2H5OH + O2 → CH3COOH + H2O
b.Oxi hóa anđehit axetic:
2CH3CHO + O2 → 2CH3COOH
c.Oxi hóa ankan:
2R-CH2-CH2-R’ + 5O2 → 2RCOOH + 2R’COOH + 2H2O
VD: CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O
d.Từ metanol:
CH3OH + CO → CH3COOH
Bài tập vận dụng
Câu 1. Sử dụng hóa chất nào dưới đây để nhận biết 2 dung dịch mất nhãn HCOOH và CH3COOH
A. dung dịch AgNO3/NH3
B. quỳ tím
C. Na2CO3
D. NaOH
Lời giải:
Đáp án: A
Câu 2. Để phân biệt ancol etylic và axit axetic, ta dùng hóa chất nào sau đây:
A. Na
B. Dung dịch AgNO3
C. CaCO3
D. Dung dịch NaCl
Lời giải:
Đáp án: A
Câu 3. Trong các dung dịch sau: Fructozơ, glixerol, saccarozo, ancol etylic và tinh bột. Số dung dịch phản ứng được Cu(OH)2 ở nhiệt độ thường là:
A. 4
B. 5
C. 3
D. 1
Lời giải:
Đáp án: C