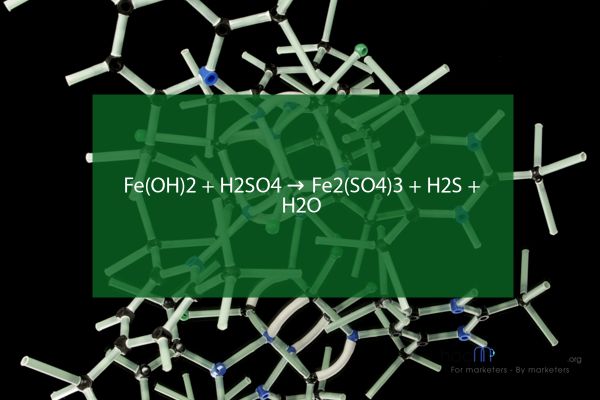
Fe(OH)2 + H2SO4 → Fe2(SO4)3 + H2S + H2O

Phản ứng trao đổi giữa Fe(OH)2 và H2SO4 tạo ra Fe2(SO4)3, H2S và H2O Fe(OH)2 và H2SO4 tương tác để hình thành sản phẩm này Trạng thái và tính chất của các chất tham gia cũng như ứng dụng liên quan cần được xem xét
1. Phương trình phản ứng giữa Fe(OH)2 và H2SO4 đặc:
Phản ứng giữa Fe(OH)2 và H2SO4 đặc là một loại phản ứng oxi-hoá khử, trong đó kim loại sắt trong Fe(OH)2 bị oxi hóa và ion H+ trong H2SO4 bị khử. Phản ứng được biểu diễn bởi phương trình sau:8Fe(OH)2 + 13H2SO4 → 4Fe2(SO4)3 + H2S + 20H2O
Phản ứng này tạo thành các sản phẩm sau:
1.1. Điều kiện để phản ứng phát sinh:
, kim loại sắt sulfat (Fe2(SO4)3), khí H2S và nước. Trong quá trình phản ứng, Fe(OH)2 bị oxi hóa thành Fe2(SO4)3 và ion H+ trong H2SO4 bị khử thành khí H2S. Để phản ứng giữa Fe(OH)2 và H2SO4 đặc xảy ra, cần đáp ứng điều kiện nhiệt độ thường và dung dịch H2SO4 đặc nóng thừa. Nhiệt độ thường giúp quá trình phản ứng diễn ra ổn định và hiệu quả, trong khi dung dịch H2SO4 đặc nóng thừa giúp tăng tốc độ phản ứng.1.2. Hiện tượng sau phản ứng:
Sau khi phản ứng xảy ra, kim loại sắt bị tan chậm dần trong dung dịch H2SO4 đậm nóng thừa, tạo thành một dung dịch có màu nâu vàng chứa sắt sulfat và khí H2S. Khí H2S có một mùi đặc trưng là mùi trứng thối và không có màu sắc. Việc tạo ra khí H2S trong quá trình phản ứng này cũng có thể được sử dụng để phát hiện sự hiện diện của H2S trong môi trường khác.2. Bản chất của các chất tham gia phản ứng:
2.1. Bản chất của Fe(OH)2 (Sắt (II) hidroxit):
Trong các phản ứng hóa học, các chất tham gia đóng vai trò quan trọng trong việc tạo thành sản phẩm cuối cùng. Fe(OH)2 là một chất tham gia quan trọng được sử dụng trong nhiều phản ứng khác nhau.Trong các phản ứng với Fe(OH)2, nó được coi là một chất khử, có khả năng cung cấp electron cho các chất khác, từ đó gây ra quá trình khử. Tuy nhiên, Fe(OH)2 là một bazo không tan và phản ứng với axit. Cụ thể, Fe(OH)2 có tính chất bazơ vì nó có thể nhận proton và tạo ra ion OH-.
Ngoài ra, Fe(OH)2 còn có những tính chất khác như khả năng hấp thụ các ion kim loại và hình thành các hợp chất phức với các ion kim loại khác. Điều này cho thấy vai trò quan trọng của Fe(OH)2 trong nhiều ứng dụng khác nhau như sản xuất phân bón, thuốc nhuộm và chất tẩy rửa.
2.2. Bản chất của H2SO4 (Axit sunfuric):
H2SO4 có vai trò quan trọng trong nhiều phản ứng hóa học khác nhau. Khi phản ứng với H2SO4, các chất khử khác bị oxi hoá do tác động mạnh của nó.H2SO4 có nhiều đặc tính khác như tính axit mạnh, khả năng oxi hoá mạnh và khả năng hút ẩm cao. Ngoài ra, axit sulfuric còn được sử dụng trong nhiều lĩnh vực khác nhau như sản xuất phân bón, chất tẩy rửa và thuốc nhuộm. Điều này chứng tỏ vai trò quan trọng của H2SO4 trong nhiều ứng dụng khác nhau, và là một chất tham gia hóa học cần thiết.
2.3. Bản chất của NaOH (Hidroxit natri):
Trong phản ứng hóa học, vai trò của các chất tham gia rất quan trọng trong quá trình hình thành sản phẩm cuối cùng. Trong nhiều phản ứng khác nhau, NaOH là một chất tham gia quan trọng được sử dụng.Trong phản ứng với NaOH, nó hoạt động như một chất bazơ. Điều này có nghĩa là NaOH có khả năng nhận proton và tạo ra ion OH-. Tính chất bazơ của NaOH được thể hiện qua khả năng tan trong nước và khả năng tác dụng với axit. Cụ thể, NaOH có khả năng tác động lên các chất axit khác, tạo ra phản ứng trung hòa.
Ngoài ra, NaOH còn được ứng dụng rộng rãi trong nhiều ngành công nghiệp khác nhau như sản xuất giấy, luyện kim, thuốc nhuộm và chất tẩy rửa. Điều này chứng tỏ vai trò quan trọng của NaOH trong nhiều ứng dụng khác nhau, và nó là một chất tham gia cần thiết trong các phản ứng hóa học.
3. Mở rộng kiến thức về Fe(OH)2:
3.1. Tính chất vật lý và nhận biết:
Fe(OH)2 là một chất kết tủa màu xanh dương trắng, có khả năng dẫn điện và dễ dàng bị oxi hóa chuyển thành màu nâu đỏ khi tiếp xúc với không khí. Chúng có khả năng tan ít trong nước.Fe(OH)2 có khối lượng riêng là 3,4 g/cm³ và độ dẫn điện là 3,1 × 10⁻⁴ S/m.
Phương pháp nhận biết Fe(OH)2 là sử dụng dung dịch NaOH để kết tủa Fe(OH)2, sau đó thêm dung dịch NH₄Cl để tạo thành kết tủa màu trắng. Kết tủa này có thể tan trong dung dịch HCl và dung dịch này được sử dụng để xác định hàm lượng Fe(OH)2 trong mẫu.
3.2. Tính chất hóa học:
Fe(OH)2 là một chất không tan có tính bazơ. Nó có khả năng tương tác với nhiều axit và chất oxi hóa khác.Fe(OH)2 có cùng lúc tính oxi hóa và tính khử. Điều này cho phép nó tương tác với nhiều chất khác nhau trong các phản ứng hóa học.
a. Tách phân bằng nhiệt
Khi nung Fe(OH)2 trong môi trường không có không khí, chất này sẽ tách phân thành FeO và H2O theo phản ứng: Fe(OH)2 → FeO + H2O. Màu của Fe(OH)2 sẽ chuyển từ màu trắng xanh sang màu nâu đỏ.
Khi tác dụng với axit, Fe(OH)2 sẽ tạo thành muối kim loại và nước.
Với axit không có tính oxi hóa như (HCl, H2SO4), Fe(OH)2 tác dụng để tạo ra muối sắt (II) và nước theo phản ứng: Fe(OH)2 + 2HCl → FeCl2 + 2H2O.
c. Tính khử:
Với axit HNO3, H2SO4 đặc, Fe(OH)2 tác dụng để tạo ra các muối sắt (III) và khí NO hoặc SO2:
3Fe(OH)2 + 10HNO3 loãng → 3Fe(NO3)3 + NO + 8H2O.
2Fe(OH)2 + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O.
Khi tác động với các chất oxi hóa khác, Fe(OH)2 phản ứng với oxy và nước để tạo thành Fe(OH)3 theo công thức: 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3.
3.3. Điều chế:
Fe(OH)2 có thể được tổng hợp bằng cách trộn dung dịch bazơ vào dung dịch muối sắt (II) trong điều kiện không có không khí. Quá trình tạo ra Fe(OH)2 được biểu diễn qua phương trình hóa học: Fe2+ + 2OH- → Fe(OH)2.Ngoài ra, Fe(OH)2 cũng có thể được tổng hợp bằng cách hòa tan muối sắt (II) trong dung dịch NaOH. Phản ứng diễn ra như sau: FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl.
Fe(OH)2 cũng có thể được sản xuất thông qua việc pha dung dịch NH4OH vào dung dịch FeSO4, sau đó lắng kết tủa Fe(OH)2 và phơi mạch.
4. Tính chất hoá học của H2SO4:
4.1. H2SO4 loãng:
Axit sunfuric có tính chất mạnh và đa dụng, vượt trội so với các loại axit khác. Nó không chỉ có các tính chất hóa học chung của axit mà còn có nhiều ứng dụng quan trọng.Một trong những ứng dụng hữu ích của axit sunfuric là khả năng làm đổi màu quỳ tím sang màu đỏ. Điều này cực kỳ hữu ích trong việc xác định tính chất của các chất trong các phản ứng hóa học. Bên cạnh đó, axit sunfuric cũng có khả năng tạo muối sunfat khi tác dụng với các kim loại đứng trước H (ngoại trừ Pb). Chẳng hạn, việc cho Fe phản ứng với H2SO4 sẽ tạo ra FeSO4 và H2, phản ứng này thường được sử dụng rộng rãi trong phòng thí nghiệm.
Ngoài ra, axit sunfuric cũng có khả năng phản ứng với oxit bazơ để tạo ra muối mới (trong đó kim loại giữ nguyên hóa trị) và nước, ví dụ như khi ta cho FeO tác dụng với H2SO4, kết quả thu được là FeSO4 và H2O.
FeO + H2SO4 → FeSO4 + H2O
Cũng như tác dụng với bazo để tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 cũng có khả năng phản ứng với muối để tạo thành muối mới (với hóa trị của kim loại không thay đổi) và axit mới, ví dụ như việc H2SO4 tác dụng với Na2CO3 để tạo ra Na2SO4, H2O và CO2:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
Hoặc tác dụng của H2SO4 với KHCO3 để tạo ra K2SO4, H2O và CO2:
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
4.2. H2SO4 đặc:
Khác với axit sunfuric loãng, axit sunfuric đặc có tính axit mạnh và tính chất hóa học nổi bật hơn. Ví dụ, khi thả một mảnh Cu vào H2SO4 đặc, ta có thể tạo ra một dung dịch màu xanh và khí bay ra với mùi sốc:Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
H2SO4 đặc cũng có khả năng phản ứng với các phi kim, tạo thành oxit phi kim, H2O và SO2. Một ví dụ là phản ứng giữa H2SO4 đặc với cacbon, tạo thành CO2, H2O và SO2 (ở nhiệt độ cao):
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
Hoặc phản ứng của H2SO4 đặc với P để tạo ra H3PO4, SO2 và H2O:
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Ngoài ra, axit sunfuric đặc cũng có thể tác dụng với những chất khử khác như phản ứng giữa H2SO4 đặc và FeO để hình thành Fe2(SO4)3, SO2 và H2O:
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O.
Cuối cùng, axit sunfuric đặc cũng có tính hấp nước đặc trưng. Bạn có biết không, khi bạn đổ H2SO4 vào cốc chứa đường, phản ứng sẽ xảy ra và đường sẽ chuyển thành màu đen và bắn tung toé cùng với phản ứng hóa học như sau:
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Câu hỏi vận dụng liên quan:
Câu 1. Chọn phát biểu đúng trong các phát biểu sauA. Chất oxi hóa là chất nhường electron.
B. Quá trình nhận electron là quá trình oxi hóa.
C. Chất khử là chất nhận electron.
D. Quá trình nhường electron là quá trình oxi hóa.
Đáp án D
Chất khử là chất cho e (bị oxi hóa)
Chất oxi hóa là chất nhận e (bị khử)
Quá trình của e là quá trình oxi hóa, quá trình nhận e là quá trình khử.
Câu 2. Cho phản ứng sau: Fe + H2SO4 → Fe2(SO4)3 + H2S + H2O. Tổng số hệ số tối giản trong phương trình trên là:
A. 40
B. 48
C. 52
D. 58
Đáp án A
Phương trình phản ứng hóa học
8Fe + 15H2SO4 → 4Fe2(SO4)3+ H2S + 12H2O
Câu 3. Cho phương trình hóa học : 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3. Kết luận nào sau đây là đúng?
A. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
B. Fe(OH)2 là chất khử, O2 là chất oxi hoá.
C. O2là chất khử, H2O là chất oxi hoá.
D. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá
Đáp án B
4+2Fe(OH)2 + 0O2 + 2H2O → 4+3Fe(−2OH)3.
Quá trình cho – nhận e:
+2Fe → +3Fe + 1e => Fe(OH)2 là chất khử
0O2+ 4e → 2−2O=> O2 là chất oxi hóa
Câu 4. Phát biểu nào dưới đây không đúng?
A. Sự oxi hóa là sự mất (nhường) electron
B. Sự khử là sự mất electron hay cho electron
C. Chất khử là chất nhường (cho) electron
D. Chất oxi hóa là chất thu electron
Đáp án B
Nắm được khái niệm:
+ Chất khử là chất nhường e
+ Chất oxi hóa là chất nhận e
+ Sự khử là sự nhận e
+ Sự oxi hóa là sự nhường e













