CO2 + NaOH → NaHCO3

CO2 + NaOH → NaHCO3 là một phản ứng quan trọng trong hóa học, tạo ra sodium bicarbonate (baking soda) từ carbon dioxide và sodium hydroxide Bài viết này cung cấp thông tin chi tiết về phương trình, điều kiện và hiện tượng phản ứng, cùng với phương trình rút gọn Ngoài ra, cũng có bài tập vận dụng liên quan giúp độc giả nắm vững kiến thức Mời bạn tham khảo!
1. Phương trình phản ứng CO2 + NaOH → NaHCO3:
CO2 + NaOH → NaHCO3
2. Điều kiện phản ứng xảy ra CO2 + NaOH → NaHCO3:
– Dẫn khí CO2 từ từ đến dư vào ống nghiệm chứa NaOH và vài giọt chất chỉ thị.Trong quá trình phản ứng, khí CO2 tương tác với dung dịch NaOH để tạo ra Na2CO3 và H2O. Sau đó, Na2CO3 tiếp tục phản ứng với CO2 khác trong môi trường nước để tạo thành NaHCO3. Phản ứng này thường được sử dụng để hấp thụ CO2 từ không khí hoặc khí thải nhằm giảm lượng CO2 trong môi trường.
4. Phương trình rút gọn của CO2 + NaOH → NaHCO3:
Bước 1: Viết phương trình phân tử:CO2 + NaOH → NaHCO3
Bước 2: Đồng bộ hoá phương trình ion bằng cách: chuyển các chất dễ tan và điện li mạnh thành ion; chất điện li yếu, chất kết tủa và chất khí giữ nguyên trong dạng phân tử:
CO2 + Na+ + OH– → Na+ + HCO3–
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách loại bỏ các ion giống nhau ở cả hai vế:
5. Bài tập vận dụng liên quan:
Cấu trúc phân tử.– Cấu tạo của CO2 là O = C = O.
– Phân tử CO2 có cấu tạo thẳng, không phân cực.
Tính chất vật lý
– Là chất khí không màu, nặng gấp 1,5 lần không khí.
– Tan ít trong nước.
– CO2 khi bị làm lạnh đột ngột chuyển sang trạng thái rắn, gọi là nước đá khô.
– Đá khô không nóng chảy mà thăng hoa làm nên chất lỏng lạnh và khô hữu ích, rất tiện lợi để bảo quản thực phẩm.
Lưu ý: Trong quá trình sử dụng đá khô, cần đeo guốc chống lạnh để tránh bị đát lạnh gây nhỏng khi tiếp xúc với đá khô.
Tính chất hóa học
– Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
– CO2 là oxit axit, khi tan trong nước tạo thành axit cacbonic:
CO2 (k) + H2O (l) ⇄ H2CO3 (dd)
CaO + CO2 →to”>to→ CaCO3
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Điều chế
a. Trong phòng thí nghiệm
– CO2 được điều chế bằng cách cho dung dịch HCl tác dụng với đá vôi.
– Phương trình hóa học:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
b. Trong công nghiệp
– Khí CO2 được thu hồi từ quá trình đốt cháy hoàn toàn than để cung cấp năng lượng cho các quá trình sản xuất khác.
- Bên cạnh đó, CO2 cũng được tái chế từ việc biến đổi khí thiên nhiên, dầu mỏ; quá trình nung vôi; quá trình lên men rượu từ đường glucozơ.
CaCO3 →to”>to→→ CaO + CO2
C6H12O6 2CO2 + 2C2H5OH
Bài tập vận dụng liên quan
Câu 1:Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2, hiện tượng quan sát được là
A. có kết tủa, lượng kết tủa tăng dần, kết tủa không tan.
B. không có hiện tượng gì trong suốt quá trình thực hiện.
C. lúc đầu không thấy hiện tượng, sau đó có kết tủa xuất hiện.
D. có kết tủa, lượng kết tủa tăng dần, sau đó kết tủa tan.
Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
Câu 2: "Nước đá khô" có khả năng thăng hoa dễ dàng mà không cần chảy, vì vậy nó được sử dụng để tạo môi trường lạnh và khô, rất thuận tiện cho việc bảo quản thực phẩm. "Nước đá khô" đề cập đến SO2 rắn.
B. CO2 rắn.
C. CO rắn.
D. H2O rắn.
Hướng dẫn giải:
Đáp án B
Nước đá khô là CO2 rắn.
Câu 3:Cho khí CO2 vào lượng dư dung dịch nào sau đây sẽ tạo kết tủa?
A.MgCl2.
B. Ca(OH)2.
C. Ca(HCO3)2.
D.NaOH.
Hướng dẫn giải:
Đáp án B
A và C không phản ứng → loại.
Câu 4: Chất khí nào sau đây, được tạo ra từ bình chữa cháy và dùng để sản xuất thuốc giảm đau dạ dày?
A. CO2.
B. N2.
C. CO.
D. CH4.
Hướng dẫn giải:
Đáp án A
Chất khí được tạo ra từ bình chữa cháy là CO2.
Thuốc giảm đau dạ dày là NaHCO3.
NaOH + CO2 → NaHCO3.
Câu 5:Cho dãy các chất sau: CO2, CO, SiO2, NaHCO3, NH4Cl. Số chất trong dãy tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là:
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải:
Đáp án B
Các chất thỏa mãn là CO2, NaHCO3 và NH4Cl.
CO2 + 2NaOH → Na2CO3 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
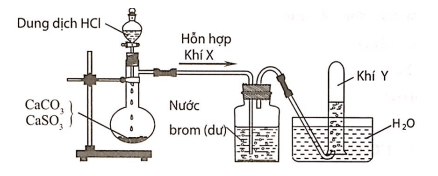
Câu 6:Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
Câu 7:Sục 1,12 lít CO2 (đktc) vào 200ml dung dịch Ba(OH)2 0,2M. Khối lượng kết tủa thu được là:
A. 5,91g.
B. 19,7g.
C. 78,8g.
D. 98,5g.
Hướng dẫn giải:
Đáp án A
Câu 8: Khi hấp thụ hoàn toàn 0,16 mol CO2 vào dung dịch Ca(OH)2 có nồng độ 0,05M trong 2 lít, sẽ tạo thành kết tủa X và dung dịch Y. Tỷ lệ khối lượng dung dịch Y so với khối lượng dung dịch Ca(OH)2 ban đầu là:
A. tăng 3,04g.
B. tăng 7,04g.
Hướng dẫn giải:
Đáp án AnCO2=0,16mol;nCa(OH)2=0,1mol→1<nCO2nCa(OH)2=1,6<2″>
Dung dịch sau phản ứng tăng 3,04 gam.
Câu 9: Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500 ml dung dịch NaOH 0,16M, thu được dung dịch X. Sau đó, thêm 250 ml dung dịch Y chứa BaCl2 0,16M và Ba(OH)2 aM vào dung dịch X, thu được 3,94g kết tủa và dung dịch Z. Giá trị của a là:
A. 0,015.
B. 0,02.
C. 0,03.
D. 0,04.
Hướng dẫn giải:
Đáp án BnCO2=0,07mol;nNaOH=0,08mol;nBa(OH)2=0,25amolnBaCl2=0,04mol;nBaCO3↓=0,02mol”>
Câu 10: Sục 8,96 lít CO2 điều kiện tiêu chuẩn vào dung dịch chứa 100 ml hỗn hợp dung dịch Ca(OH)2 2M và NaOH 1,5M, thu được kết tủa có khối lượng a gam và dung dịch X. Đun nóng dung dịch X kĩ, thu được thêm kết tủa có khối lượng b gam. Giá trị của (a + b) là
A. 5 gam
B. 15 gam
C. 20 gam
D. 40 gam
Hướng dẫn giải:
Đáp ánC
Câu 11: Hấp thụ toàn bộ 0,3 mol CO2 vào dung dịch chứa 0,25 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam?
A. tăng 13,2g.
B. tăng 20g.
Hướng dẫn giải:
Đáp án C
CHO 5,6 LÍT CO2 (ĐKTC) ĐƯỜNG QUA 164ML DUNG DỊCH NAOH 20% (D = 1,22G/ML), KẾT QUẢ LÀ DUNG DỊCH X. KHI CÔ CẠN DUNG DỊCH X, CHẤT RẮN CÓ KHỐI LƯỢNG LÀ:
A. 15,5G.
B. 26,5g.
C. 31g.
D. 46,5g.
Hướng dẫn giải:
Đáp án DnNaOH=164.1,22.20%40=1mol;nCO2=0,25mol→nNaOHnCO2=4″>
→ Chất rắn gồm NaOH dư và muối Na2CO3.
Bảo toàn nguyên tố C:
nNa2CO3=nCO2=0,25mol”>nNa2CO3=nCO2=0,25mol
Bảo toàn nguyên tố Na:
nNaOH dư = 1 – 0,25.2 = 0,5 mol
mchất rắn = 0,25.10^6 + 0,5.40 = 46,5 gam
Câu 13: Cho 3,36 lít khí CO2 (đktc) vào dung dịch chứa 500 ml KOH 0,1M và Ba(OH)2 0,12M kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là A. 2,55.
B. 3,94.
C. 1,97.
D. 4,925.
Hướng dẫn giải:
Câu 14:Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Hướng dẫn giải:
Đáp án B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
→VCO2=0,1.22,4=2,24″>→VCO2=0,1.22,4=2,24→2=0,1.22,4=2,24lít
Phản ứng điều chỉnh để cân bằng phương trình CO2 + NaOH → NaHCO3 là phản ứng hóa học giữa khí carbon dioxide (CO2) và dung dịch hidroxit natri (NaOH), tạo thành muối bicarbonate natri (NaHCO3).
Để cân bằng phương trình này, ta cần đảm bảo số nguyên tử của các nguyên tố trên cả hai bên của phương trình là như nhau.
Cách 1: Xác định số nguyên tử của từng nguyên tố trong phản ứng.
CO2 + NaOH → NaHCO3
Trên phía trái phương trình:
Carbon (C): 1 nguyên tử
Oxygen (O): 2 nguyên tử
Sodium (Na): 1 nguyên tử
Hydrogen (H): 1 nguyên tử
Hydrogen (H): 1 nguyên tử
Carbon (C): 1 nguyên tử
Oxygen (O): 3 nguyên tử
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố.
CO2 + NaOH → NaHCO3
Do phương trình chỉ có một nguyên tử carbon (C), ta cân bằng số nguyên tử carbon trên cả hai phía bằng nhau.
CO2 + NaOH → NaHCO3
Bước 3: Cân bằng số nguyên tử của các nguyên tố khác.
Trên mặt trái của phương trình, ta có 2 nguyên tử oxy (O) trong CO2. Để chỉ số oxy cân bằng ở hai mặt, ta thêm số 2 vào mặt bên phải của phương trình.
CO2 + NaOH → NaHCO3
2CO2 + NaOH → NaHCO3
Bây giờ, ta có:
Trên phía trái:
Carbon (C): 2 nguyên tử
Oxygen (O): 4 nguyên tử
Sodium (Na): 1 nguyên tử
Hydrogen (H): 1 nguyên tử
Trên phía phải:
Sodium (Na): 1 nguyên tử
Hydrogen (H): 1 nguyên tử
Bước 4: Kiểm tra lại phương trình và điều chỉnh nếu cần thiết.
2CO2 + 2NaOH → 2NaHCO3
Phương trình trên đã được cân bằng đúng về số nguyên tử của mỗi nguyên tố.