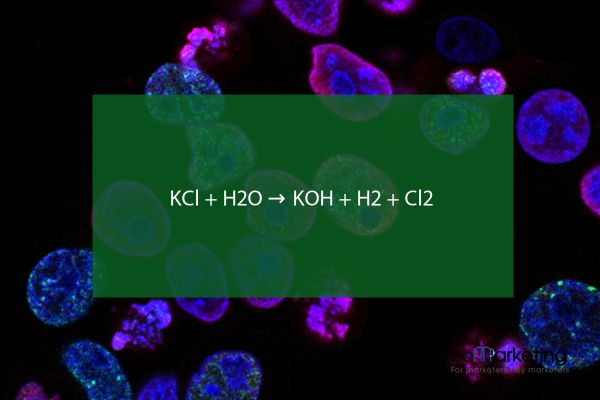
KCl + H2O → KOH + H2 + Cl2

KCl + H2O → KOH + H2 + Cl2 là phản ứng điện phân dung dịch KCl bão hòa, tạo thành KOH, H2 và Cl2 Bài viết cung cấp kiến thức chi tiết về phản ứng, cách cân bằng phương trình, hiện tượng nhận biết, điều kiện và cách thực hiện phản ứng Ngoài ra, cũng tìm hiểu về tính chất và ứng dụng của H2O và KCl Bài viết kết thúc bằng bài tập vận dụng
1. Phương trình KCl + H2O → KOH + H2 + Cl2:
1.1. Cân bằng phương trình:
Kẽm react với axit HCl tạo thành chất nhựa ZnCl2 và khí H2.1.2. Hiện tượng nhận biết phản ứng:
Khí H2 thoát ra ở cực dương, không màu và không có mùi.Sau một thời gian điện phân, ta thu được khí H2, khí Cl2 và môi trường kiềm (KOH)
1.3. Điều kiện phản ứng:
Nhiệt độ: 75°CXúc tác: Anod trơ
1.4. Cách thực hiện phản ứng:
Điện phân dung dịch KCl bão hòa, có màng ngăn giữa hai điện cựcKCl (Kali clorua)
Trong phản ứng trên KCl là chất khử.
KCl là một muối trung hoà bị điện phân dung dịch trong nước có màng ngăn xốp.
H2O (Nước)
Trong phản ứng trên H2O là chất oxi hoá.
2. Tìm hiểu về H2O ( Nước):
2.1. Định nghĩa:
H2O chính là phân tử nước được cấu tạo bởi hai nguyên tố O và H.Công thức hóa học của nước là H2O, do đó mỗi phân tử nước chứa một nguyên tử oxy và hai nguyên tử hydro. Các nguyên tử này được kết nối với nhau bằng liên kết cộng hóa trị.
Cấu trúc phân tử của H2O có góc liên kết là 104,45 độ và chiều dài liên kết O-H là 95,84 picomet.
Sự phân hủy và tổng hợp nước:
H2O (điện phân) → 2H2 + O2
2 H2 + O2 (t°) → 2 H2O
Dưới điều kiện tiêu chuẩn (25°C và 1 atm),
2.2. Tính chất vật lí:
tồn tại ở dạng lỏng. Tuy nhiên,2.2. Tính chất vật lí:
cũng có thể tồn tại dưới dạng rắn (băng) hoặc khí (hơi nước) tùy thuộc vào nhiệt độ và áp suất.Đặc điểm vật lý của nước:
Nhiệt độ nóng chảy: 0°C
Nhiệt độ sôi: 100°C
Mật độ: 1g/cm³ ở 25°C
Trạng thái vật lý: Chất này tồn tại dưới dạng lỏng ở nhiệt độ phòng và áp suất của không khí xung quanh.
Độ hòa tan: Nước là một dung môi phổ biến và có khả năng hòa tan nhiều chất khác nhau trong nó.
1. Nước có khả năng sôi ở nhiệt độ cao hơn nhiều so với các chất khác, điều này góp phần làm cho năng lượng nhiệt được cung cấp lớn khi chuyển từ trạng thái lỏng sang hơi và ngược lại.
2. Nước tinh khiết (nước cất) thực sự không dẫn điện. Nước thông thường thường chứa nhiều loại muối tan. Tuy vậy, khả năng dẫn điện của nước phụ thuộc vào tổng lượng muối có trong nước, tính chất của các muối đó và nhiệt độ nước. Nước khoáng cao thường có khả năng dẫn điện mạnh.
Tính chất dẫn nhiệt: Nước được cho là có khả năng dẫn nhiệt tốt.
2.3. Tính chất hoá học
Tính chất hóa học của nước trong chương trình hóa 8 được thể hiện qua 3 điểm sau đây.Nước tác dụng với kim loại
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Nước tác dụng với oxit bazo
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịch bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
· SO2 + H2O → H2SO3
· P2O5 + 3H2O → 2H3PO4
2.4. Ứng dụng:
H2O có nhiều ứng dụng quan trọng, bao gồm:Uống: Nước là chất lỏng quan trọng nhất cho sự sống. Tham gia vào nhiều quá trình hóa học quan trọng trong cơ thể người và động thực vật. Nó có vai trò làm giảm thiểu các chức năng cơ bản của cơ thể như làm mát, vận chuyển dưỡng chất, loại bỏ chất thải và duy trì cân bằng điện giải.
Nấu ăn: Nước được sử dụng rộng rãi trong việc chuẩn bị thức ăn, chẳng hạn như hâm nóng, nấu canh, hấp, tráng bánh và pha chế đồ uống.
Tẩy rửa và lau chùi: Nước được sử dụng để tẩy rửa các bề mặt, giặt quần áo, lau chùi đồ đạc và vệ sinh cá nhân. Đây là một dung môi an toàn và không gây hại.
Công nghiệp: Nước có vai trò quan trọng trong nhiều ngành công nghiệp, bao gồm sản xuất điện, sản xuất thép, sản xuất giấy, chế tạo các sản phẩm hóa dầu và làm mát trong quá trình vận hành nhà máy.
Nông nghiệp và tưới tiêu: Nước đóng vai trò quan trọng trong sự phát triển của ngành nông nghiệp.
Chúng ta cần thực hiện trách nhiệm bảo vệ nguồn nước và sử dụng nước một cách tiết kiệm. Hãy tránh vứt rác một cách bừa bãi xuống ao, hồ, kênh rạch và xử lý nước thải sinh hoạt và công nghiệp trước khi thải ra môi trường.
Một số thông tin về Kali Clorua (Potassium Chloride), một hợp chất vô cơ chứa kali và clo:
- Kali Clorua (Potassium Chloride) có công thức hóa học là KCl.
- Nó là một kim loại halogen muối, bao gồm cả kali và clo.
- Kali Clorua không mùi và có dạng tinh thể thủy tinh màu trắng hoặc không màu.
- Trạng thái tồn tại của kali clorua trong nước là dạng chất rắn, và dung dịch của nó có vị giống muối ăn.
- KCl (Kali clorua) có tính chất vật lý như sau: (đặt sau
3.2. Tính chất vật lí:
)KCl có trạng thái vật lý là hạt tinh thể màu trắng hoặc tạo thành tinh thể mảnh vỡ, không mùi.
KCl có nhiệt độ nóng chảy là 770 độ C, tức là nó chuyển từ trạng thái rắn sang trạng thái lỏng ở nhiệt độ này.
Điểm sôi của KCl là 1420 độ C, tức là nó chuyển từ trạng thái lỏng sang trạng thái khí ở nhiệt độ này.
KCl có khả năng tan trong nước, khi tan tạo ra dung dịch KCl. Độ tan của KCl trong nước là khá cao, khoảng 34,7g/100ml nước ở 20 độ C.
Điện tích: KCl phân ra thành ion K+ và Cl- trong dung dịch nước, giúp truyền dẫn điện.
Tính ổn định: KCl là một chất khá ổn định và không dễ phân hủy dưới điều kiện thông thường.
3.3. Tính chất hoá học:
KCl là một muối trung hòa nó mang đầy đủ tính chất hóa học của muối.Phân ly toàn trong nước tạo thành các ion âm và ion dương:
KCL → K+ + Cl–
Phản ứng với dung dịch chứa AgNO3
KCl + AgNO3 → AgCl ↓ + KNO3
Kali Clorua là muối được tạo từ bazơ mạnh và axit mạnh nên nó mang tính trung tính; do đó tương đối trơ về mặt hóa học.
Phản ứng với H2SO4 đặc để tạo ra K2SO4 và HCL
2KCl + H2SO4 đặc → K2SO4 + 2HCl
Điều chế kim loại kali trong công nghiệp (thay thế bằng kim loại natri ở nhiệt độ cao 850 ° C)
KCL + Na → K + NaCl
3.4. Ứng dụng:
KCl (Kali clorua) có nhiều ứng dụng hữu ích trong cuộc sống hàng ngày và trong ngành công nghiệp. Dưới đây là một số ứng dụng thông dụng của KCl:Được sử dụng trong thực phẩm: KCl thường được sử dụng như một thay thế cho muối, bởi vì nó có hàm lượng natri thấp hơn. Điều này có thể giúp giảm nguy cơ bị tăng huyết áp và các vấn đề về tim mạch liên quan đến việc tiêu thụ quá nhiều muối.
Dùng trong lĩnh vực y tế: KCl được dùng rộng rãi trong các ứng dụng y tế, bao gồm điều trị tình trạng thiếu kali trong cơ thể. Ngoài ra, nó còn được sử dụng để điều trị tình trạng mất nước nặng hoặc sau khi trải qua phẫu thuật.
Dùng trong lĩnh vực nông nghiệp: KCl được sử dụng như một nguồn cung cấp kali trong việc bón phân cho cây trồng. Kali là một chất dinh dưỡng vô cùng quan trọng cho sự phát triển của cây, đặc biệt là trong quá trình sinh trưởng và phát triển của hệ thống rễ và quả.
Viên nén duy trì hàm lượng calcium dương và phosphat dương trong máu và nước trong cơ thể
Xuất nhôm: KCl được sử dụng trong quá trình sản xuất nhôm để làm giảm điểm nóng chảy của nhôm và tăng tính ổn định
Luyện kim: KCl được sử dụng trong các quá trình luyện kim như tinh chế và ép kim để làm giảm điểm nóng chảy và tăng độ dẫn điện của các kim loại
4. Bài tập vận dụng:
Câu 1. Khí clo có thể tác dụng được với tất cả các chất trong dãy nào sau đây?A. H2, dung dịch NaOH, H2O
B. H2, dung dịch NaCl, dung dịch NaOH
C. H2, O2, Al
D. O2, Fe, Cu
Đáp án: A
Hướng dẫn giải
Cl2 + H2 ⟶ 2HCl
Cl2 + 2NaOH ⟶ NaCl + NaClO + H2O
H2O + Cl2 ⟶ HCl + HClO
vì các đáp án còn lại có O2, NaCl là ko tác dụng với Cl2
Câu 2. Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ), thu được khí H2 ở catot.
(b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu.
(c) Đặt thanh Zn vào dung dịch chứa CuSO4 và H2SO4, sẽ xuất hiện hiện tượng ăn mòn điện hóa.
(d) Trong các kim loại, Hg có nhiệt độ nóng chảy thấp nhất và Ag là kim loại dẫn điện tốt nhất.
(e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl.
Số phát biểu đúng là
A. 4
B. 3
C. 2
D. 5
Đáp án: A
Hướng dẫn giải
(a) đúng
2NaCl + 2H2O ⟶ 2NaOH + Cl2 (anot) + H2 (catot)
(b) Vì CO không đủ khả năng khử Al2O3 nên kết quả là sai.
(c) Đúng vì khi hỗn hợp Zn2+/Zn và Cu2+/Cu được ngâm trong dung dịch H2SO4, hai cặp oxi hóa khử khác nhau hình thành, gây ra quá trình ăn mòn điện hóa.
(d) đúng
(e) đúng, 3AgNO3 + FeCl2 → Fe(NO3)3 + 2AgCl↓ + Ag↓
=> có 4 phát biểu đúng
Câu 3. Thực hiện các thí nghiệm sau:
(1) Cho Si vào dung dịch NaOH (dư).
(2) Điện phân dung dịch NaCl dư bằng điện cực trơ, không màng ngăn xốp.
(3) Cho khí H2S vào dung dịch chứa FeCl3.
(4) Dẫn luồng khí H2 qua ống sứ chứa CuO nung nóng.
(5) Cho bột Ni vào dung dịch FeCl3 dư.
Số thí nghiệm thu được đơn chất là
A. 5
B. 3
C. 2
D. 4
Đáp án: D
Hướng dẫn giải
(1) Si + 2NaOH + H2O → Na2SiO3 + H2↑
(2) 2NaCl + H2O → NaCl + NaClO + H2
(3) H2S + 2FeCl3 → 2FeCl2 + 2HCl + S↓
(4) H2 + CuO ⟶ Cu↓ + H2O






