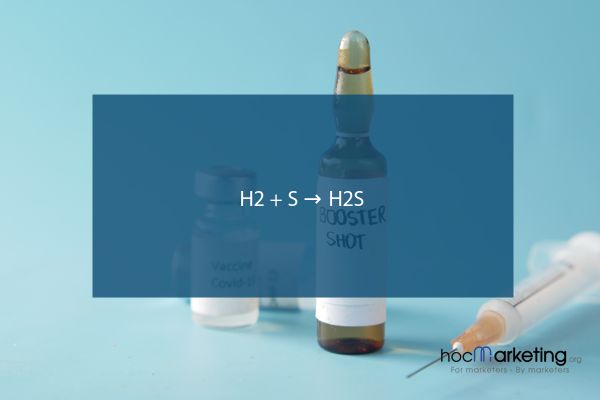
H2 + S → H2S

Hướng dẫn viết và cân bằng phản ứng H2 tác dụng với S, cung cấp kiến thức về điều kiện, cách nhận biết, thực hiện và ứng dụng của phản ứng Bài viết cũng bao gồm bài tập và hướng dẫn lời giải liên quan, cùng với thông tin chi tiết về khí H2S, từ tính chất đến ứng dụng trong đời sống
1. Phương trình phản ứng H2 tác dụng với S:
Phản ứng H2 + S → H2S tạo ra hydro sunfua, một loại khí độc và dễ cháy, có mùi trứng thối. Phản ứng xảy ra khi khí hydro (H2) phản ứng với lưu huỳnh rắn (S) ở nhiệt độ cao.Phương trình cân bằng cho phản ứng này là:
2H2 + S → 2H2S
Phương trình này cho thấy rằng hai mol khí
2. Phân tích phản ứng hóa học H2 tác dụng với S:
phản ứng với một mol lưu huỳnh để tạo ra hai mol hydro sunfua. Phản ứng tỏa nhiệt, nghĩa là nó giải phóng nhiệt dưới dạng sản phẩm. Phản ứng cũng không thể đảo ngược, nghĩa là nó không thể đảo ngược bằng cách thay đổi các điều kiện.Để xảy ra phản ứng giữa
2. Phân tích phản ứng hóa học H2 tác dụng với S:
+2.1. Điều kiện phản ứng hóa học xảy ra giữa H2 + S:
, cần có một điều kiện là nhiệt độ cao, khoảng 300 độ C và xúc tác (như Fe, Ni, Co…). Khi đó, hai nguyên tố sẽ kết hợp với nhau theo tỉ lệ 1:1 để tạo thành khí hiđro sunfua, một chất có mùi hôi thối.2.2. Cách nhận biết phản ứng:
Để nhận biết phản ứng này, ta có thể sử dụng các phương pháp sau đây:- Sử dụng mắt để quan sát màu sắc của các chất tham gia và sản phẩm. Khí hiđro không có màu sắc đặc trưng, lưu huỳnh có màu vàng, và khí hiđro sunfua không có màu sắc nhưng có thể làm thay đổi màu sắc của giấy quỳ tím.
- Đo nhiệt độ trước và sau khi xảy ra phản ứng của hỗn hợp khí. Phản ứng H2 + S → H2S là một phản ứng tỏa nhiệt, tức là sau khi phản ứng xảy ra, nhiệt độ của hỗn hợp khí sẽ tăng lên.
- Sử dụng giấy quỳ tím để kiểm tra tính axit hoặc bazơ của hỗn hợp khí. Khí hiđro sunfua là một chất axit yếu, vì vậy nó sẽ làm cho giấy quỳ tím chuyển sang màu đỏ.
2.3. Thực hiện phản ứng:
– Chuẩn bị nguyên liệu: Chúng ta cần chuẩn bị H2 và S. H2 có thể lấy từ nhiều nguồn khác nhau như khí đốt, nước, axit hay kim loại... Trong khi đó, S có thể được lấy từ lưu huỳnh tự nhiên, quặng sulfua, hay khí thiên nhiên...– Điều kiện phản ứng: Để thực hiện phản ứng này, chúng ta cần tạo ra một môi trường nhiệt độ cao (khoảng 300°C) và sử dụng xúc tác (như Fe, Ni, Co...). Môi trường nhiệt độ cao là cần thiết để kích hoạt phản ứng giữa H2 và S. Sử dụng xúc tác sẽ giúp tăng tốc độ phản ứng và giảm năng lượng kích hoạt.
– Cách thực hiện phản ứng: Có thể sử dụng phương pháp trực tiếp hoặc gián tiếp. Phương pháp trực tiếp là đặt H2 và S vào một bình kín có chứa xúc tác và đun nóng. Phương pháp gián tiếp là đưa H2 vào một bình chứa S nóng chảy cùng với chất xúc tác.
– Sản phẩm của phản ứng: H2S. H2S là một chất khí có mùi hôi đặc trưng, có tính axit yếu và có khả năng gây ngộ độc nếu hít phải. H2S cần được thu gom và xử lý một cách an toàn.
2.4. Ứng dụng của phản ứng:
Một số ứng dụng khác của phản ứng này bao gồm:- Làm chất xúc tác cho quá trình sản xuất hợp chất hữu cơ và không hữu cơ.
- Sử dụng trong lĩnh vực chế tạo phân bón và sản xuất thuốc diệt cỏ.
- Tạo ra các sản phẩm hóa học như axit sunfuric và sunfat kim loại.
- Sử dụng trong các quy trình xử lý nước, làm công cụ tẩy trắng và xử lý nước cất.
- Trong lĩnh vực năng lượng, phản ứng này có thể được sử dụng để tạo nhiên liệu từ hydro gốc sinh học.
- Cung cấp hydro sunfat cho sản xuất xi măng và sản xuất gốm sứ.
- Được sử dụng trong quá trình làm sạch và thủy tinh hoá lưu huỳnh.
- Phát điện bằng cách chuyển đổi năng lượng hóa học từ hydro sunfua thành năng lượng điện.
- Để kiểm tra sự hiện diện của khí hydro trong mẫu, ta có thể thêm lưu huỳnh và quan sát xem hydro sunfua có được hình thành hay không.
2.5. Lưu ý đối với phản ứng:
Một số nguy cơ tiềm ẩn khi tiến hành phản ứng này bao gồm:– Sự tồn tại của hydro sunfua có thể gây ra những hiểm họa nguy hiểm như suy hô hấp, tử vong hoặc ngất xỉu nếu hít thở với nồng độ cao.
- Hydro sunfua là một loại khí dễ cháy và có thể phát nổ nếu bị tiếp xúc với tia lửa hoặc ngọn lửa.
- Hydrogen sulfide là một loại khí ăn mòn có thể gây hư hại cho kim loại, cao su và nhựa.
– Hydrogen sulfide là một chất khí có mùi hôi thối, có thể gây buồn nôn, nhức đầu hoặc kích ứng nếu ngửi thấy ở nồng độ thấp.
2.6. Cách thực hiện cân bằng phương trình:
Để cân bằng phương trình H2 + S → H2S, chúng ta cần xác định số mol của cả chất tham gia phản ứng và sản phẩm. Quy tắc đơn giản sau có thể được sử dụng:- Nếu chỉ có một chất ở một bên của phương trình, ta sẽ gán hệ số cho chất đó bằng số nguyên tử của nguyên tố có số nguyên tử nhiều nhất trong phương trình.
- Nếu có nhiều hơn một chất ở một bên của phương trình, ta sẽ gán hệ số cho chất chứa nhiều nguyên tố nhất trước, sau đó đến chất chứa ít nguyên tố nhất.
-Nếu vẫn chưa đạt được sự cân đối, ta tiếp tục thực hiện các bước trên cho đến khi đạt được sự cân bằng.
Áp dụng quy tắc đều này, chúng ta có thể cân bằng phương trình H2 + S → H2S theo cách sau đây:
– Bên trái của phương trình có H2 và S. Bên phải chỉ có H2S. Ta gán hệ số 2 cho H2S vì nó chứa hai nguyên tử hiđro.
– Sau khi gán hệ số cho H2S, ta thấy số nguyên tử hiđro ở hai bên phương trình bằng nhau, nhưng số nguyên tử lưu huỳnh vẫn không bằng nhau. Ta gán hệ số 2 cho S vì nó chứa một nguyên tử lưu huỳnh.
- Sau khi gán giá trị cho S, ta nhận thấy số nguyên tử lưu huỳnh ở hai phía của phương trình là bằng nhau, tuy nhiên số nguyên tử hiđro ở hai phía lại không còn cân đối. Ta gán giá trị cho H2 là 2, vì có hai nguyên tử hiđro.
- Sau khi gán giá trị cho H2, ta thấy số nguyên tử hiđro và lưu huỳnh ở hai phía của phương trình đã cân đối. Phương trình đã được cân bằng.
Vậy phương trình H2 + S → H2S sau khi cân bằng là: 2H2 + S → 2H2S.
3. Bài tập vận dụng liên quan:
Câu 1: Khi sục một mẫu khí thải gồm H2S, NO2, SO2, CO2 vào dung dịch CuSO4, ta thấy xuất hiện kết tủa màu đen. Hiện tượng này được gây ra bởi chất nào trong khí thải?A. H2S
B. NO2
C. SO2
D. CO2
Câu 2: Khí nào sau đây có khả năng làm mất màu Brom?
A. N2
B. CO2
C. H2
D. SO2
Câu 3: Trường hợp nào sau đây không xảy ra phản ứng hóa học:
A. H2 + S → H2S
B. FeCl2 + H2S → FeS + 2HCl
C. 3S + 2P → P2S3
D. SO3 + 2NaOH → Na2SO4 + H2O
Câu 4: Magie photphua có công thức là:
A. Mg2P2O7
B. Mg2P3
C. Mg3P2
D. Mg3(PO4)2
4. Hướng dẫn lời giải:
Câu 1:Đáp án: A. H2S
Câu 2:
Đáp án:
D. SO2
Câu 3:
Đáp án: B. FeCl2 + H2S → FeS + 2HCl
Câu 4:
Đáp án: C. Mg3P2
5. Tìm hiểu thêm về H2S:
5.1. H2S là chất gì?
Khí H2S (hay còn được gọi là hydro sunfua) là một chất hóa học có đặc tính đặc trưng dễ dàng nhận biết.H2S có cấu trúc giống như phân tử nước, được tạo thành từ 2 nguyên tử hiđro và 1 nguyên tử sunfua, trong đó sunfua là nguyên tử trung tâm và có hai nguyên tử hiđro gắn với nhau bằng liên kết đơn.
Tuy nhiên, lưu huỳnh không có tính phân cực như oxi, do đó H2S không phân cực như nước. Vì vậy, H2S có lực tương tác giữa các phân tử yếu hơn và điểm sôi cũng như điểm nóng chảy thấp hơn nhiều so với nước. H2S thường được hình thành khi chất hữu cơ bị phân hủy bởi vi sinh vật trong môi trường thiếu oxi (phân hủy trong môi trường không khí). Hydrogen sulfide cũng được tìm thấy trong khí từ núi lửa, dầu mỏ, khí tự nhiên và một số giếng hoặc suối nước nóng. Đáng chú ý, cơ thể con người cũng tổng hợp một lượng nhỏ H2S, chất này được sử dụng như một phân tử truyền tín hiệu.
5.2. Tính chất vật lí:
- Có một mùi trứng thối rất đặc trưng.‐ Là một loại khí dễ cháy.
‐ Điểm sôi của nước là 100 độ C và hydro sunfua – 60 độ C.
- Đây là một chất khí đặc hơn và có trọng lượng cao hơn so với không khí. Tuy nhiên, nó có khả năng hòa tan tốt trong nước và các dung môi hữu cơ.
- Đây là một loại khí không màu và độc hại, có thể gây đau đầu nếu hít phải một lượng nhỏ.
‐ Ở áp suất trên 90 GPa, H2S trở thành chất dẫn kim loại.
5.3. Tính chất hóa học:
Tính axit yếu:‐ Có tính axit nên làm giấy quỳ tím chuyển sang màu đỏ.
‐ H2S có khả năng phản ứng với dung dịch kiềm tạo muối trung hòa và nước.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + H2O
‐ H2S có phản ứng với dung dịch muối cacbonat tạo muối trung hòa và nước.
H2S + Na2CO3 → NaHCO3 + NaHS
Tính khử mạnh: H2S có tác dụng là chất khử, chủ yếu là khí và có bazơ tạo ra SH.
Phản ứng dưới đây có thể gây nổ khi hỗn hợp không khí và H2S kết hợp:
2H2S+ 3O2 → 2H2O + 2SO2 H2S
Phản ứng với kim loại tạo muối sunfua kim loại không hòa tan và thường là chất rắn có màu sẫm:
2H2S + 2K → 2KHS + H2
H2S phản ứng với Ag tạo muối sulfite:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
H2S bị oxy hóa khi phản ưngs với Clo tạo thành H2SO4 khi có nước:
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
5.4. Ứng dụng của khí H2S trong đời sống:
‐ Trong Hóa học phân tích được sử dụng để xác định các cation.- H2S là hợp chất ban đầu của lưu huỳnh. Vì vậy, các hợp chất lưu huỳnh như S, H2SO4 và một số hợp chất hữu cơ như methanethiol, ethanethiol và axit thioglycolic được sử dụng để sản xuất sunfua kim loại, bao gồm cả các chất được ứng dụng trong công nghiệp sơn.
- Quy trình Girdler sulphide được sử dụng để tách deuterium oxide hoặc nước nặng từ nước thông thường.
‐ Trong lĩnh vực nông nghiệp, H2S được sử dụng như một chất khử trùng.
‐ Trong lĩnh vực y tế, việc tiếp xúc tế bào với một lượng nhỏ H2S có thể giúp ngăn ngừa tổn thương cơ thể.
‐ Trong gia công kim loại, gia công cơ khí: H2S là một phần của dầu cắt, chất làm mát và chất bôi trơn.






