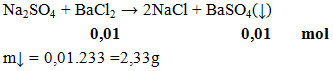BaCl2 + Na2SO4 → BaSO4 + NaCl

BaCl2 + Na2SO4 → BaSO4 + NaCl là phản ứng hóa học quan trọng và được sử dụng phổ biến trong các ứng dụng công nghiệp và phòng thí nghiệm Bài viết này cung cấp thông tin chi tiết về phản ứng, điều kiện, hiện tượng và phương trình rút gọn của phản ứng này, đồng thời cung cấp bài tập vận dụng liên quan Hãy tham khảo ngay!
1. Phương trình phản ứng BaCl2 + Na2SO4 → BaSO4 + NaCl:
Na2SO4 + BaCl2 → 2NaCl + BaSO4( ↓)
2. Điều kiện phản ứng xảy ra BaCl2 + Na2SO4 → BaSO4 + NaCl:
Phản ứng trong Điều kiện thường.Điều kiện phản ứng xảy ra trong phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + 2NaCl là:
- Phản ứng xảy ra trong dung dịch: Thường thì, BaCl2 và Na2SO4 được hoà tan trong nước để tạo thành dung dịch trước khi phản ứng diễn ra.
- Các chất BaCl2 và Na2SO4 cần hiện diện trong dung dịch để phản ứng với nhau.
- Chất lượng và hiệu suất phản ứng có thể bị ảnh hưởng bởi pH của dung dịch, vì phản ứng xảy ra trong môi trường dung dịch.
– Nhiệt độ: Thông thường, việc tăng nhiệt độ có thể làm gia tăng tốc độ phản ứng. Tuy nhiên, cần chú ý rằng đối với một số phản ứng, nhiệt độ quá cao có thể làm giảm hiệu suất phản ứng.
– Cân bằng ion: Các ion có mặt trong dung dịch như Cl-, SO42-, Na+ và Ba2+ cần phải được cân bằng để tạo thành các hợp chất mới.
– Tương tác phân tử: Đối tượng của tất cả các chất tham gia cần được tương tác hóa học phù hợp để phản ứng xảy ra.
3. Hiện tượng phản ứng giữa BaCl2 + Na2SO4 → BaSO4 + NaCl:
Có hiện tượng kết tủa màu trắng.Phản ứng giữa BaCl2 (clorua bari) và Na2SO4 (sunfat natri) tạo ra BaSO4 (sunfat bari) và NaCl (clorua natri) theo phương trình hoá học sau:
– BaCl2 + Na2SO4 → BaSO4 + 2NaCl
- Trong phản ứng này, ion bari từ BaCl2 kết hợp với ion sunfat từ Na2SO4 để hình thành kết tủa sunfat bari (BaSO4), trong khi hai ion natri từ Na2SO4 tạo thành muối clorua natri (NaCl).
- Đây là một phản ứng trao đổi ion, trong đó các ion của các chất tham gia hoán đổi vị trí để tạo ra sản phẩm mới. Kết tủa BaSO4 có màu trắng và không tan trong nước, trong khi NaCl tan trong nước và màu trắng.
– Phản ứng này cũng có thể được sử dụng để phân biệt giữa các ion bari và sunfat trong phân tích hóa học.
4. Phương trình rút gọn của BaCl2 + Na2SO4 → BaSO4 + NaCl:
Phương trình rút gọn cho phản ứng BaCl2 + Na2SO4 → BaSO4 + 2NaCl là:BaCl2 + Na2SO4 → BaSO4 + 2NaCl
5. Bài tập vận dụng liên quan:
Cách cân bằng phương trình BaCl2 + Na2SO4 → BaSO4 + NaCl:Phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + 2NaCl có thể được cân bằng bằng cách điều chỉnh số lượng phân tử của các chất trong phương trình. Dưới đây là quy trình để cân bằng phương trình:
- Đầu tiên, kiểm tra số lượng nguyên tố trên cả hai phía của phương trình. Phía trái có 1 nguyên tố Ba, 2 nguyên tố Cl, 1 nguyên tố Na và 1 nguyên tố S. Phía phải có 1 nguyên tố Ba, 1 nguyên tố S và 2 nguyên tố Cl. Vì vậy, cần điều chỉnh số lượng phân tử để nguyên tố trên cả hai phía phương trình trở nên bằng nhau.
- Bắt đầu với nguyên tố Ba, ta thấy cả hai bên đều có 1 nguyên tố Ba. Do đó, không cần điều chỉnh số lượng các phân tử Ba.
- Tiếp theo, đến nguyên tố Cl. Bên trái có 2 nguyên tố Cl trong BaCl2, trong khi bên phải chỉ có 2 nguyên tố Cl trong 2NaCl. Vì vậy, không cần điều chỉnh số lượng các phân tử Cl.
- Tiếp theo, có nguyên tố Na. Bên trái có 2 nguyên tố Na trong Na2SO4, trong khi bên phải có 2 nguyên tố Na trong 2NaCl. Vì vậy, không cần điều chỉnh số lượng phân tử Na.
- Cuối cùng, có nguyên tố S. Bên trái có 1 nguyên tố S trong Na2SO4, trong khi bên phải có 1 nguyên tố S trong BaSO4. Để cân bằng, cần thêm một phân tử BaSO4 bên trái để có đủ nguyên tố S.
Vậy phương trình đã được cân bằng như sau: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Các mẹo để cân bằng phương trình hóa học chuẩn nhất BaCl2 + Na2SO4 → BaSO4 + NaCl:
Để cân bằng phương trình hóa học BaCl2 + Na2SO4 → BaSO4 + NaCl, bạn có thể tiến hành theo các bước sau:
Xác định số lượng và nguyên tố của từng nguyên tố trong phương trình.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Ba: 1; Na: 2; Cl: 2; S: 1; O: 4
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Cân bằng oxi bằng cách thêm hệ số phù hợp vào các hợp chất chứa oxi.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Cuối cùng, cân bằng hidro bằng cách thêm hệ số phù hợp vào các hợp chất chứa hidro.
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Sau các bước trên, phương trình đã được cân bằng: BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Phản ứng BaCl2 + Na2SO4 → BaSO4 + NaCl có cách giải như sau:
Trong phản ứng này, các ion trong BaCl2 và Na2SO4 sẽ trao đổi vị trí để tạo ra BaSO4 và NaCl, tạo thành các chất mới.
Phản ứng được viết thành phương trình cân bằng như sau:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Để giải phương trình này, ta cần xác định hệ số phân tử phù hợp cho mỗi chất trong phản ứng. Trong trường hợp này, hệ số phân tử đã được cung cấp trước và không cần điều chỉnh. Phương trình trên đã được cân bằng với những hệ số phân tử như vậy.
Tóm lại, để giải phương trình BaCl2 + Na2SO4 → BaSO4 + NaCl, chúng ta chỉ cần viết phương trình cân bằng và xác định hệ số phân tử tương ứng cho mỗi chất trong phản ứng.
Ví dụ 1:
nhỏ từ từ một vài giọt Na2SO4 vào ống nghiệm có chứa 1ml BaCl2 thu được kết tủa có màu
A. trắng. B. đen. C. vàng. D. nâu đỏ.
Hướng dẫn giải
Na2SO4 + BaCl2 → 2NaCl + BaSO4( ↓)
BaSO4( ↓) trắng
Đáp án A
Ví dụ 2:
Chất nào sau đây không thể phản ứng với Na2SO4?
A. (CH3COO)2Ba. B. BaCl2. C. Ba(NO3)2. D, BaCO3.
Hướng dẫn giải
BaCO3 không phản ứng với Na2SO4.
Đáp án D.
Ví dụ 3:
Khối lượng kết tủa thu được khi cho Na2SO4 phản ứng vừa đủ với 100ml BaCl2 0,1M là
A. 2,33g. B. 1,88g. C.1,44g. D. 2,00g
Hướng dẫn giải
Đáp án A.
Câu 1. Để nhận ra sự có mặt của SO42- trong dung dịch, người ta thường dùng chất nào dưới đây?
A. quỳ tím.
B. dung dịch muối Mg2+ .
C. dung dịch chứa ion Ba2+
D. thuốc thử duy nhất là Ba(OH)2
Đáp án C
Để nhận ra sự có mặt của ion SO42- trong dung dịch, người ta dùng dung dịch chứa ion Ba2+.
Câu 2. Trong số 3 dung dịch HCl, Ba(NO3)2 và H2SO4 được đựng trong 3 bình riêng biệt, chất nào được sử dụng làm thuốc thử duy nhất để phân biệt các dung dịch trên?
A. dung dịch NaCl
B. dung dịch AgNO3
C. dung dịch NaOH
D. quỳ tím
Đáp án D
Sử dụng quỳ tím ta nhận biết được 2 nhóm chất:
Nhóm axit HCl, H2SO4 làm quỳ tím chuyenr màu đỏ
Không làm quỳ tím đổi màu là muối Ba(NO3)2
Sử dụng dung dịch Ba(NO3)2để nhận biết nhóm axit
Mẫu thử nào xuất hiện kết tủa trắng thì dung dịch axit ban đầu là H2SO4
Ba(NO3)2+ H2SO4 → BaSO4 + 2HNO3
Không có hiện tượng gì là HCl
Câu 3. Cho dung dịch Na2SO4 vào dung dịch BaCl2 thấy
A. dung dịch chuyển đỏ.
B. có kết tủa trắng.
C. không có hiện tượng.
D. có bọt khí thoát ra
Đáp án B
Phương trình phản ứng
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Câu 4. Cho các phản ứng sau
(1) BaCl2 + H2SO4;
(2) Ba(OH)2 + Na2SO4;
(3) BaCl2 + (NH4)2SO4
(4) Ba(OH)2 + (NH4)2SO4;
(5) Ba(OH)2 + H2SO4;
(6) Ba(NO3)2 + H2SO4
Số phản ứng có phương trình ion rút gọn: Ba2+ + SO42-→ BaSO4 là:
A. 4
B. 3
C. 5
D. 6
Xem đáp ánĐáp án A
(1) BaCl2 + H2SO4 → BaSO4 + 2HCl
Phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4
(2) Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
Phương trình ion rút gọn:
Ba2+ + SO42-→ BaSO4
(3) BaCl2 + (NH4)2SO4→ 2NH4Cl + BaSO4
phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4
(4) Ba(OH)2+ (NH4)2SO4 → BaSO4+ 2NH3 + 2H2O
(5) Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
(6) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
Câu 5. Phản ứng nào dưới đây là phản ứng trao đổi ion trong dung dịch?
A. Zn + H2SO4 → ZnSO4 + H2
B. BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
C. 2Fe(NO3)3 + 2KI → 2Fe(NO3)2 + I2 + 2KNO3
D. Zn + 2Fe(NO3)3 → Zn(NO3)2 + 2Fe(NO3)2
Đáp án B Câu 6. Khi cho dung dịch NaOH vào dung dịch muối nitrat nào thì không thấy kết tủa?
A. Cu(NO3)2.
B. Fe(NO3)3.
C. AgNO3.
D. Pb(NO3)2.
Đáp án D
Chọn D vì Pb(OH)2 là hiđroxit lưỡng tính nên tan trong kiềm dư.
Pb(NO3)2 + 2NaOH → Pb(OH)2↓ + 2NaNO3
Pb(OH)2+ 2NaOH → Na2PbO2+ 2H2O
Câu 7. Cho X là một hỗn hợp gồm CaCO3 và MgCO3 có khối lượng 26,8 gam. Đổ hỗn hợp X vào dung dịch HCl có đủ lượng, thu được 3,36 lít khí (ở điều kiện tiêu chuẩn) và dung dịch Y chứa m gam muối clorua. Giá trị của m là A. 30,1.
B. 31,7.
C. 69,4.
D. 28,45.
Đáp án D
2H+ + CO32- → CO2 + H2O
nCl– = nH+ = 2nCO2 = 0,3 mol
m = mX – mCO32- + mCl– = 26,8 – 0,15.60 + 0,3.35,5 = 28,45 gam
Câu 8. Có bao nhiêu chất tạo kết tủa với BaCl2 trong: KOH; Na2SO4; SO3; NaHSO4; K2SO4; Ca(NO3)2
A. 3
B. 6
C. 5
D. 4
Đáp án D
Các chất đó là: SO3; NaHSO4; Na2SO4; K2SO4
BaCl2 + SO3 → BaSO3 + Cl2
BaCl2+ NaHSO4 → BaSO4 + NaCl + HCl
BaCl2 + Na2SO4→ BaSO4 + 2NaCl
BaCl2 + K2SO4 → BaSO4+ 2KCl