2Cu + O2 → 2CuO - Phản ứng oxy hóa khử

Bài viết này giải thích phản ứng oxy hóa khử 2Cu + O2 → 2CuO, bao gồm các thành phần, cơ chế, điều kiện và ứng dụng của phản ứng trong các ngành công nghiệp như sản xuất đồng, đồ gốm và pin.
Giới thiệu
Phản ứng oxy hóa khử là một loại phản ứng hóa học quan trọng trong nhiều lĩnh vực khoa học và công nghiệp. Trong phản ứng này, các nguyên tử hoặc ion trao đổi electron, dẫn đến sự thay đổi số oxy hóa của chúng. Phản ứng 2Cu + O2 → 2CuO là một ví dụ điển hình của phản ứng oxy hóa khử, trong đó đồng (Cu) bị oxy hóa và oxy (O2) bị khử. Bài viết này sẽ cung cấp một cái nhìn tổng quan về phản ứng oxy hóa khử, cơ chế của phản ứng 2Cu + O2 → 2CuO và các ứng dụng của nó trong các lĩnh vực khác nhau.
Tổng quan về phản ứng oxy hóa khử
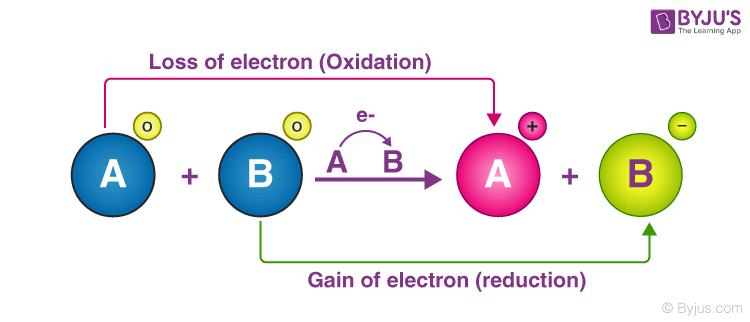
Phản ứng oxy hóa khử là gì?
Phản ứng oxy hóa khử là một loại phản ứng hóa học trong đó có sự trao đổi electron giữa các nguyên tử hoặc ion. Trong phản ứng này, một số nguyên tử hoặc ion bị oxy hóa (mất electron), trong khi một số khác bị khử (nhận electron).
Các loại phản ứng oxy hóa khử
Có nhiều loại phản ứng oxy hóa khử khác nhau, bao gồm:
- Phản ứng kết hợp: Hai hoặc nhiều chất phản ứng kết hợp với nhau để tạo thành một sản phẩm duy nhất.
- Phản ứng phân hủy: Một chất phản ứng phân hủy thành hai hoặc nhiều sản phẩm.
- Phản ứng thế: Một nguyên tử hoặc ion trong một chất phản ứng được thay thế bằng một nguyên tử hoặc ion khác.
- Phản ứng trao đổi: Hai hoặc nhiều chất phản ứng trao đổi các nguyên tử hoặc ion với nhau.
Vai trò của chất oxy hóa và chất khử
Trong phản ứng oxy hóa khử, chất oxy hóa là chất nhận electron, trong khi chất khử là chất mất electron. Chất oxy hóa thường là một chất có ái lực electron cao, trong khi chất khử thường là một chất có ái lực electron thấp.
Phản ứng 2Cu + O2 → 2CuO
 |
 |
Phương trình hóa học của phản ứng
Phản ứng oxy hóa khử giữa đồng (Cu) và oxy (O2) có thể được biểu diễn bằng phương trình hóa học sau:
2Cu + O2 → 2CuO
Các thành phần tham gia phản ứng
Chất phản ứng:
- Đồng (Cu): Chất khử, cung cấp electron cho phản ứng.
- Oxy (O2): Chất oxy hóa, nhận electron trong phản ứng.
Sản phẩm:
- Đồng(II) oxit (CuO): Hợp chất được tạo thành từ đồng và oxy.
Cách cân bằng phản ứng
Để cân bằng phản ứng, cần đảm bảo số nguyên tử của mỗi nguyên tố ở hai vế của phương trình phải bằng nhau. Trong trường hợp này, phương trình đã cân bằng vì:
- Số nguyên tử Cu: 2 ở cả hai vế
- Số nguyên tử O: 2 ở cả hai vế
Cơ chế phản ứng 2Cu + O2 → 2CuO
Sự hình thành ion Cu2+
Trong phản ứng, đồng (Cu) đóng vai trò là chất khử. Khi tiếp xúc với oxy (O2), các nguyên tử đồng nhường đi 2 electron để tạo thành các ion đồng (II) (Cu2+):
Cu → Cu2+ + 2e-
Sự hình thành ion O2-
Oxy (O2) đóng vai trò là chất oxy hóa. Khi nhận 2 electron từ đồng, các phân tử oxy chuyển đổi thành các ion oxy (II) (O2-):
O2 + 4e- → 2O2-
Sự kết hợp các ion để tạo thành CuO
Các ion đồng (II) (Cu2+) và ion oxy (II) (O2-) kết hợp với nhau theo tỷ lệ 1:1 để tạo thành hợp chất đồng (II) oxit (CuO):
Cu2+ + O2- → CuO
Phản ứng tổng thể có thể được biểu diễn như sau:
2Cu + O2 → 2CuO
Điều kiện xảy ra phản ứng 2Cu + O2 → 2CuO
Nhiệt độ
Phản ứng 2Cu + O2 → 2CuO là phản ứng tỏa nhiệt, nghĩa là giải phóng nhiệt khi xảy ra. Do đó, nhiệt độ cao sẽ làm tăng tốc độ phản ứng. Nhiệt độ tối ưu để phản ứng diễn ra nhanh chóng là khoảng 300-400°C.
Áp suất
Áp suất không ảnh hưởng đáng kể đến tốc độ phản ứng 2Cu + O2 → 2CuO. Tuy nhiên, áp suất cao có thể làm tăng nồng độ các chất phản ứng, dẫn đến tăng tốc độ phản ứng.
Chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong phản ứng. Trong phản ứng 2Cu + O2 → 2CuO, một số chất xúc tác có thể được sử dụng để tăng tốc độ phản ứng, chẳng hạn như:
- Đồng (II) oxit (CuO)
- Niken (II) oxit (NiO)
- Mangan (IV) oxit (MnO2)
Các chất xúc tác này hoạt động bằng cách cung cấp một con đường phản ứng khác có năng lượng hoạt hóa thấp hơn, giúp phản ứng diễn ra nhanh hơn.
Ứng dụng của phản ứng 2Cu + O2 → 2CuO
Trong sản xuất đồng
Phản ứng 2Cu + O2 → 2CuO đóng vai trò quan trọng trong quá trình sản xuất đồng. Quặng đồng thường chứa đồng dưới dạng hợp chất sunfua. Để chiết xuất đồng, người ta nung quặng trong không khí để xảy ra phản ứng oxy hóa khử, tạo thành đồng(II) oxit (CuO). Sau đó, CuO được khử bằng than cốc để thu được đồng nguyên chất.
Trong sản xuất đồ gốm
Trong sản xuất đồ gốm, phản ứng 2Cu + O2 → 2CuO được sử dụng để tạo ra men gốm màu xanh lục. Men gốm là lớp phủ thủy tinh được nung trên bề mặt đồ gốm để tạo độ bóng và bảo vệ. Khi thêm đồng(II) oxit vào men gốm, nó sẽ phản ứng với các thành phần khác trong men để tạo ra màu xanh lục đặc trưng.
Trong sản xuất pin
Phản ứng 2Cu + O2 → 2CuO cũng được ứng dụng trong sản xuất pin. Trong pin nhiên liệu, đồng(II) oxit được sử dụng làm chất xúc tác cho phản ứng oxy hóa hydro. Chất xúc tác này giúp tăng tốc độ phản ứng, tạo ra điện năng hiệu quả hơn.
Tổng kết
Phản ứng 2Cu + O2 → 2CuO là một phản ứng oxy hóa khử quan trọng có nhiều ứng dụng trong công nghiệp. Phản ứng này liên quan đến sự oxy hóa của đồng và sự khử của oxy, dẫn đến sự hình thành oxit đồng (II).
Cơ chế phản ứng phức tạp, liên quan đến sự hình thành các ion Cu2+ và O2-, sau đó kết hợp để tạo thành CuO. Nhiệt độ, áp suất và chất xúc tác đều ảnh hưởng đến tốc độ phản ứng.
Phản ứng này có nhiều ứng dụng trong sản xuất đồng, đồ gốm và pin. Hiểu được cơ chế và điều kiện của phản ứng này rất quan trọng để tối ưu hóa các quá trình công nghiệp liên quan.